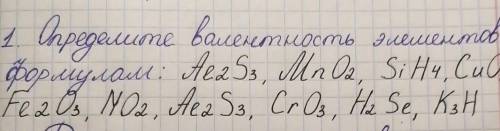
Объяснение:существим решение:
1. В соответствии с условием задачи составим уравнение:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O - реакция ионного обмена, выделяется оксид углерода (4);
2. Вычисление молярных масс веществ:
M (Na2CO3) = 105,8 г/моль;
M (HCl) = 36,5 г/моль;
M (CO2) = 44 г/моль.
3. Рассчитаем число моль карбоната натрия, соляной кислоты:
Y (Na2CO3) = m / M = 20 / 105,8 = 0,189 моль (вещество в недостатке);
Y (HCl) = m / M = 40 / 36,5 = 1 моль (вещество в избытке);
Расчеты производим с учетом вещества в недостатке.
Y (CO2) = 0,189 моль так как количество соли Na2CO3, СО2 равны по уравнению 1 моль.
4. Находим объём оксида углерода:
V (CO2) = 0,189 * 22,4 = 4,23 л.
ответ: в процессе реакции выделяется углекислый газ объёмом 4,23 л.
Al2S3= Al(валентность 3),S(вал.2)
MnO2=Mn(4),O(2)
SiH4=Si(4),H(1)
CuO=Cu(2),O(2)
Fe2O3=Fe(3),O(2)
NO2=N(4),O(2)
Al2S3=Al(3),S(2)
CrO3=Cr(6),O(2)
H2Sе=Н(1),Se(2)
K3H=такого же быть не может... Калий имеет валентность 1,и водород тоже 1, может быть что там KH, и будет что калий одновалентен, и водород тоже