1.Сначала найдем через относительную плотность молекулярную массу вещества:
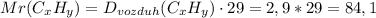
2.Теперь найдем массы Углерода и Водорода за массами продуктов горения:
а)масса Углерода:
44 г углекислого газа содержит 12 г Углерода,а
6,6 г________________________х г, откуда х=6,6*12/44=1,8 г
б)масса Водорода:
18 г воды содержит 2 г Водорода,а
2,7 г_____________у г, откуда у=2*2,7/18=0,3 г
3.Если сложить полученные массы,то получится 2,1 г,значит это углеводород.так как действительно состоит из атомов Водорода и Углерода(если бы этой суммы не хватало бы,то разница между массой вещества и этими двумя массами элементов,дало бы массу третьего элемента,Кислорода,это на будущее).Теперь поделив каждую массу элемента на массу всего вещества,получим массовые доли этих элементов:
w(C)=1,8/2,1=0,8571 или 85,71%
w(H)=100% - w(C)=100 - 85,71=14,29%
4.Теперь осталось найти количество атомов каждого из элементов в веществе.Для этого необходимо вспомнить формулу по определению массовой доли элемента в веществе и вывести из нее n:
n(C)=Mr(CxHy)*w(C)/Ar(C)*100%=84,1*85,71/12*100=6
n(H)=Mr(CxHy)*w(H)/Ar(H)*100%=84,1*14,29/1*100=12
Вот и выходит,что формула углеводорода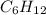 -это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу
-это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу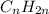
5) 16.2г х г
3CuSO4 плюс 2Al равно Al2(SO4)3 плюс3Cu
54 г 192 г
54 г равно:27 г на моль умножить на 2 моль;
192 г равно: 64 г на моль умножить на 3 моль;
16,2 : х равно 54 :192;
откуда масса меди 57,6 г
7) Разделив 21,6 г на 27 г на моль (молярн масса Al) имеем 0,8 моль алюминия, а 51,2 г на 32 г на моль 1,6 моль серы, т е отношение1:2;
алюминий и сера образуют сульфид алюминия Al2S3, отношение 2:3
1:2 то же, что и 2:4 откуда видно, что одна четвертая часть серы останется непрореагировавшей, как говорят, в избытке; масса образовавшейся соли: 21,6 плюс три четверти от 51,2, что равно 60 г
a) 4Li + O2 = 2Li2O
б) 4Al + 3O2 = 2Al2O3
в) 2Fe + 3Cl2 = 2FeCl3
г) 2Fe + 2H2O + O2 = 2Fe(OH)2