1) В пределах одной группы металлические свойства возрастают при увеличении порядкового номера элемента. Это связано с увеличением радиуса атома и более легким отхождением электронов от ядра.
ОТВЕТ: а)
2) Имея только один электрон на внешнем энергетическом уровне, элемент может иметь валентность только 1, соответственно может содержать только одну ОН группу и два атома на кислород в окисде.
ОТВЕТ: в)
3) Как уже было сказано в первом номере, в одной группе радиус атома увеличивается с увеличением его порядкового номера.
ОТВЕТ: г)
4) Щелочные металлы невероятно активны, и всячески стремятся перейти в устойчивую для себя форму иона, с зарядом +1. Поэтому в свободной форме в природе не встречаются и окислительных свойств не проявляют почти совсем, а восстановительных в степени окисления +1 в принципе не могут проявлять, но что правда про них, это то, что их действительно почти все можно спокойно резать ножом и намазывать на хлеб, главное потом не есть)
ОТВЕТ: в)
5) Реакция натрия с водой невероятно экзотермична. Натрий как бешеный носится по поверхности и искрит. В то же время это является реакцией замещения водорода на натрий. Продуктом реакции является щелочь.
ОТВЕТ: в)
6) Основные свойства щелочей тем выше, чем активнее металл, входящий в соединение наиболее активным металлом является литий.
ОТВЕТ: а)
7) С раствором щелочи точно не могут взаимодействовать основные соединения. Могут лишь кислотные и амфотерные. Могут таже растворимые соли, если в результате реакции получается нерастворимвый гидроксид.
ОТВЕТ: б)
8) Соли натрия содержает его ионы. Ионы натрия окрашивают пламя горелки в желтый цвет.
ОТВЕТ: г)
9) Каустическая сода (она же едкий натр) - тривиальное название гидроксида натрия
ОТВЕТ: в)
10) Хлорид соединие вида 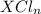 , сульфид
, сульфид 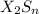 , гидрид
, гидрид 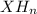 .
.
ОТВЕТ: в)
m(Na2SO3) = 126 г,
ω(Na2SO3) = 10%,
m(HCl) = 73 г,
ω(HCl) = 10%.
Решение:
1) составим уравнение реакции:
Na2SO3 + 2HCl = 2NaCl + H2О + SO2↑
из уравнения видно, что количество вещества n(Na2SO3) отностся к
n(SO2), как 1:1 (по коэффициентам),
2) по формуле n=m/M рассчитываем количество вещества сульфита натрия, но для этого найдем массу его вещества, т.к. нам дана в условии лишь масса его раствора:
m(вещ-ва) Na2SO3 = (m (р-ра)*ω) /100%,
m(вещ-ва) Na2SO3 = (126 г *10%)/100% = 12,6 г.
3) рассчитаем молярную массу вещества: M (Na2SO3) = 23*2 + 32 + 16 *3 = 126 г/моль,
4) найдем количество вещества:
n (Na2SO3) = 12,6 г/ 126 г/моль = 0,1 моль,
5) n(SO2) = n(Na2SO3) = 0,1 моль,
6) из формулы n = V/ Vm найдем объем сернистого газа, учитывая, что Vm = 22,4 л/моль.
получим: V (SO2) = n * Vm = 0,1 моль * 22,4 л/моль = 2,24 л.
ответ: объем сернистого газа равен 2,24 л.
Удачи;)