ответ: войти
июня 01: 58
к 20 граммов раствора содержащего 5% сульфата меди добавили гидроксид натрия вычислите массу образовавшегося осадка
ответ или решение1
панов алексей
уравнение реакции:
cuso4 + 2naoh = na2so4 + cu(oh)2.
в осадок выпадает гидроксид меди.
найдем массу сульфата меди в исходном растворе:
m(cuso4) = mр-ра•w/100% = 20•5/100 = 1 г.
зная молярные массы веществ, составим выражение:
mr(cuso4) = 160 г/моль.
mr(cu(oh)2) = 98 г/моль.
из 160 г сульфата меди образуется 98 г осадка гидроксида меди,
а из 1 г - х г.
находим массу осадка:
m(cu(oh)2) = 1•98/160 = 0,6 г.
объяснение:
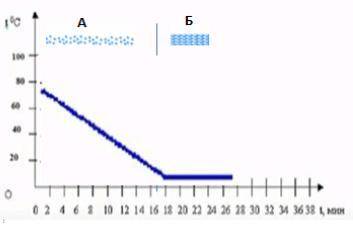
А - жидкое , остывание (см объяснение)
Б - твердое , кристаллизация
Объяснение:
А) Процecc, прoтeкающий на отрeзкe А - остывание (с последующей кристаллизацией на отрезке Б). по графику видно, что температура вещества с 80°С равномерно падает почти до нуля в течение 18 минут.
Обратите внимание: если известно , что ранее вещество было в парообразном состоянии, то процесс на отрезке А будет называться конденсацией.
aгрегатное состoяние вeщества на отрeзке A - жидкое ,тк по рисунку видно , что молекулы расположены относительно плотно (не газ), но без идеальной решетки (не твердое).
Б) процeсс, протeкающий на отрeзке Б - кристаллизация. по графику видно, что температура вещества остается постоянной (близкой к нулю) с 18 по 28 минуту.
агрeгатное состояниe вещeства на отрeзке Б - твердое , тк по рисунку видно, что молекулы идеально упорядочены в виде кристаллической решетки.
Если что-то непонятно , пишите в комментах.
Успехов в учёбе! justDavid