Задача №1
Дано:
m(Zn)=13 г
-----
Найти:
m(соли) - ?
Решение
Реакция: 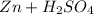 ⇒
⇒ 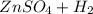 ↑
↑
ν(Zn) = 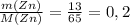 моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
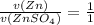 - по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
- по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
Тогда:
ν(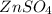 ) = ν(Zn) = 0,2 моль
) = ν(Zn) = 0,2 моль
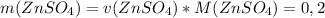 моль
моль  г/моль = 32,2 г
г/моль = 32,2 г
*молярная масса сульфата цинка была посчитана из таблицы Менделеева: M(Zn) + M(S) + 4*M(O) = 65 г/моль + 32 г/моль + 4*16 г/моль = 161 г/моль
ответ: 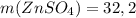 г
г
Задача №2
Дано:
m(HCl) = 127,3 г
-----
Найти:
m(газа) - ?
Решение
Реакция: 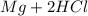 ⇒
⇒  ↑
↑
ν(HCl) = 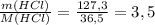 моль
моль
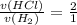 - по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
- по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
Тогда:
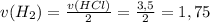 моль
моль
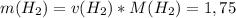 моль
моль 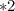 г/моль = 3,5 г
г/моль = 3,5 г
ответ: 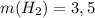 г.
г.
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
1. Составляем уравнение реакции
a A + b B → c C
a моль b моль c моль
2. Нахождение количества вещества реагентов ν(А) и ν(В): ν = m/M; ν = V/Vm; Wвещества = (mвещества •100%)/mраствора; mвещества= (Wвещества• mраствора)/100% 3. Сравнение дробей – нахождение недостатка:ν(А)/a и ν(В)/b
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)Если, ν(А)/a < ν(В)/b, то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/a = ν(В)/b, то расчёт ν(С) ведём по ν(В) или ν(А)4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/b = ν(С)/с или ν(А)/a = ν(С)/с5. Нахождение величин, требуемых по условию:
m = ν•M;V = ν•Vm;Wвещества = (mвещества •100%)/mраствораРешите задачи по теме: «Избыток – Недостаток»
Первый уровень
1. На оксид магния количеством вещества 0,1 моль подействовали раствором, содержащим 15 г азотной кислоты. Вычислите массу полученной соли. (ответ: m Mg(NO3)2)= 14,8 г)
2. Вычислите массу соли, образовавшейся в результате взаимодействия 7,3 г хлороводорода с 5,6 л аммиака (н. у.) (ответ: m(NH4Cl) = 10,7 г)
3. Вычислите объём водорода, выделившегося при взаимодействии цинка массой 13 г с раствором, содержащим 30 г серной кислоты (н.у.). (ответ: V(H2) = 4,48 л)
Второй уровень
1. Какое количество вещества гидросульфата натрия образуется при смешивании 200 г 12% - го раствора серной кислоты со 100 г 8% - го раствора гидроксида натрия? (ответ: 0,2 моль)
2. К раствору объёмом 153,5 мл с массовой долей гидроксида калия 16% и плотностью 1,14 г/мл прилили раствор объёмом 86,8 мл с массовой долей серной кислоты 20% и плотностью 1,14 г/мл. Определите массу образовавшейся соли. (ответ: 34,8 г K2SO4)
Третий уровень
1. Смешали 100 г раствора, содержащего нитрат серебра массой 10,2 г, с раствором массой 50 г, содержащим ортофосфат натрия массой 6, 56 г. Определите массовые доли солей в полученном растворе. (ответ: 3,6% NaNO3; 2,3% Na3PO4)
2. Водный раствор, содержащий гидроксид кальция массой 3,7 г, поглотил оксид углерода (IV) объёмом 1,68 л (н. у.). Определите массу осадка. (ответ: m(CaCO3) = 2,5 г)
а) Mr(KOH) = 56
W(K) = Ar(K) *n / Mr(KOH) *100% = 39*1 / 56 *100% = 69,6%
W(O) = Ar(O) * n / Mr(KOH) *100% = 16*1 / 56 *100% = 28,6%
W(H) = Ar(H) * n / Mr(KOH) *100% = 1*1 / 56 *100% = 1,8%
б) Mr(TeO3) = 176
W(Te) = Ar(Te) *n / Mr(TeO3) *100% = 128 * 1 / 176 *100% = 73%
W(O) = Ar(O) * n / Mr(TeO3) *100% = 16 * 3 / 176 *100% = 27%
в) Mr(CuSO4) = 159,5
W(Cu) = Ar(Cu) * n / Mr(CuSO4) *100% = 63,5 * 1 / 159,5 *100% = 40%
W(S) = Ar(S) * n / Mr(CuSO4) *100% = 32 *1 / 159,5 *100% = 20%
W(O) = Ar(O) * n / Mr(CuSO4) *100% = 16 * 4 / 159,5 *100% = 40%
32,2 г, 39 литров
Объяснение:
1) Запишем уравнение реакции:
Zn + H₂SO₄ = ZnSO₄ + H₂
n(Zn) = n(ZnSO₄) = 13 г / 65 г/моль = 0,2 моль
m(ZnSO₄) = 0,2 моль * 161 г/моль = 32,2 г
2) Запишем уравнение реакции:
Mg + 2HCl = MgCl₂ + H₂
n(HCl) = 127,3 г / 36,5 г/моль ≈ 3,4877 моль
n(H₂) = 1/2 n(HCl) = 1,74385 моль
V(H₂) = 1,74385 моль * 22,4 л/моль ≈ 39 л