с контрольно 1. Количество атомов в ходе химической реакции: а) изменяется; б) не изменяется; в) в одних реакциях изменяется, в других – нет.
2. Что такое относительная атомная масса?
3. Определить валентности элементов в оксидах: Fe2O3, Al2O3, N2O, V2O5, SO2.
4. Написать формулы соединений элементов с азотом (III): H, Be, Ca, Na, O, Al.
5. Из приведенных формул выписать отдельно формулы простых и сложных веществ: Ca, Ne, HF, P, SiO2.
6. Из приведенных ниже названий явлений выписать отдельно названия физических и химических явлений: замерзание воды, пожелтение листьев, плавление пластмассы, горение бумаги, высыхание лужи.
7. Рассчитайте относительную молекулярную массу веществ: Cr2O3, Zn3(PO4)2.
8. Расставите коэффициенты в уравнениях реакций и укажите их тип:
а) Fe(OH)2 ® FeO + HOH;
б) P + Cl2 ® PCl5.
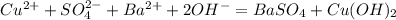
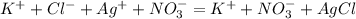
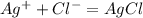
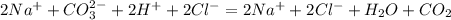
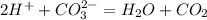
Кислоты бывают органические и неорганические
Классификация кислот.
По основности: Одноосновные HCl, HNO₃, Двухосновные H₂S, H₂SO₄, Трехосновные H₃PO₄ .
По содержанию кислорода: Кислородсодержащие HClO₄,H₂SO₄.
Бескислородные HCl, H₂S.
По силе (степени диссоциации): сильные:HI, HClO4, H2SO4, HCl , HNO3 средние H₂SO₃, H₃PO₄; слабые H₂СO₃, H₂S, H₂SiO₃
По стабильности: Стабильные H₂SO₄, H₃PO₄, HCl .
Нестабильные H₂CO₃ H₂SiO₃ H₂SO₃
По растворимости: Растворимые H₂SO₄ HCl HNO₃ и другие Нерастворимые H₂SiO₃
По летучести: Летучие : HCl, HNO₃
Нелетучие: H₃PO₄, H₂SO₄