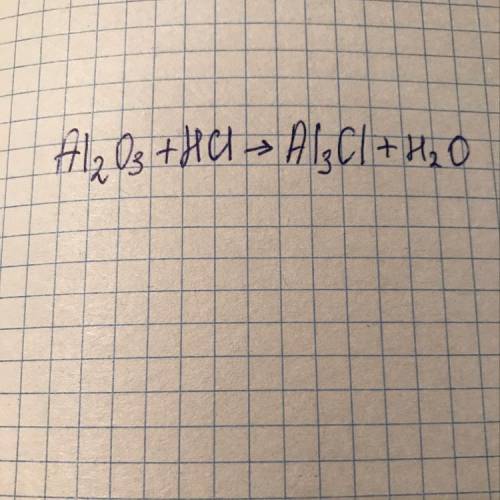
к раствору аминоуксусной кислоты
массой 100 г с массовой долей кислоты 0.15 прибавили такой же массы соляную кислоту с массовой долей хлороводорода 0,073. определите массу образовавшейся соли и какой будет среда в растворе после завершения реакции.
Попроси больше объяснений Следить Отметить нарушение Schlafwandler 07.05.2014
ответ
ответ дан
Alchemist96
Alchemist96
NH2СH2COOH + HCl = NH4ClCH2COOH
m(NH2СH2COOH) = 100*0,15 = 15г ; n(NH2СH2COOH) = 15г/75г/моль = 0,2 моль
m(HCl) = 100*0,073 = 7,3г n(HCl) = 7,3г/36,5г/моль = 0,2 моль
в-ва реагируют в соотношении 1:1, n(NH4ClCH2COOH) = n(HCl) = 0,2 моль
m(NH4ClCH2COOH) = 0,2*111,5 = 22,3 г
Среда кислая, так как происходит диссоция
NH4ClCH2COOH = NH4ClCH2COO(-) + H(+)
ответ:Al2O3 + 6HCl-2AlCl3+3H2O
Объяснение: у тебя ошибка будет AlCl3