Молекулярная масса аммиака равна 17. Значит, по отношению к аммиаку все газы тяжелее его. Из предложенных выше газов аммиак будет взаимодействовать со следующими:
1. С водой (аммиак хорошо растворяется в воде, образуя гидрат или гидроксид)
NH3 + H2O > NH3*H2O ---> NH4OH.
2. С хлороводородом (признак реакции: "дым без огня"):
NH3 + HCl > NH4Cl ( полученный хлорид аммония используют при пайке металлов)
3. С азотной кислотой:
NH3 + HNO3 ---> NH4NO3 (полученный нитрат аммония (селитра) используют в качестве удобрений)
4. C кальцием:
2NH3 + Ca > Ca(NH2)2 + H2 (образуется амид кальция)
5. С кислородом:
4NH3 + 3H2O > 2N2 + 6H2O (некаталитическое окисление)
4NH3 + 5H2O > 4NO + 6H2O (каталитическое окисление, катализатор: платина)
6. С оксидом меди:
NH3 + 2CuO > N2 + Cu + H2O (лабораторный получения азота)
Цвета различных индикаторов в растворах кислот и щелочей приведены в таблице 8-6. С их определяют кислотность или щелочность раствора. Для проявления окраски достаточно добавить в исследуемый раствор всего лишь 1-2 капли 0,1% раствора индикатора.
Таблица 8-6. Окраска индикаторов в растворах щелочей и кислот.
Цвет индикатора в растворах:
Название индикатора:
в кислых
в нейтральных
в щелочных
Лакмус
Фенолфталеин
Метилоранж
красный
бесцветный
красный
фиолетовый
бледно-розовый
оранжевый
синий
малиновый
желтый
Индикаторы можно условно считать слабыми кислотами, соли которых в растворе имеют иную окраску. Эта окраска не зависит от атома металла, входящего в состав соли. Например, запишем формулу лакмуса в виде "кислоты" НЛ (здесь Н – атом водорода, а Л – часть молекулы лакмуса, имеющей сложное строение). В растворах изменение окраски лакмуса происходит в результате реакции нейтрализации:
HЛ
+
NaOH
=
NaЛ
+
H2O
эти молекулы окрашивают раствор в красный цвет
эти молекулы окрашивают раствор в синий цвет
А вот как изменяет окраску растворов индикатор фенолфталеин НФ:
HФ
+
NaOH
=
NaФ
+
H2O
эти молекулы бесцветны
эти молекулы окрашивают раствор в малиновый цвет
Если после появления малиновой окраски в щелочной раствор фенолфталеина добавить избыток какой-нибудь кислоты, то произойдет обратная реакция и раствор вновь станет бесцветным:
NaФ
+
HCl
=
HФ
+
NaCl
малиновый
бесцветный
Изменение окраски фенолфталеина при нейтрализацииВ опыте из "Единой коллекции образовательных ресурсов" показывается, как такой индикаторный переход (изменение цвета раствора) происходит при нейтрализации раствора NaOH уксусной кислотой CH3COOH.
Изменение окраски происходит резко – как только в растворе не останется NaOH. На этом явлении основано определение неизвестной концентрации раствора какого-нибудь основания или кислоты с добавления раствора кислоты или основания известной концентрации. Такой называется титрованием.
Титрование проводится с бюретки – стеклянной трубки с краником, на которую нанесены деления с точностью до 0,1 мл. В бюретку наливают раствор кислоты или щелочи точно известной концентрации (рис.8-1).
Допустим, надо определить концентрацию раствора NaOH. Точно отмеренный объем этого раствора наливают в колбу для титрования, добавляют индикатор (рис. 8-1а) и по каплям приливают из бюретки раствор кислоты, концентрация которого известна. С бюретки точно измеряется объем кислоты, необходимый для полной нейтрализации раствора - в этот момент окраска раствора исчезает (рис. 8-1б). Поскольку точно известна концентрация кислоты, взятой для титрования, не составляет труда рассчитать и концентрацию щелочи.
 моль ⇒ n(C)=0,3 моль
моль ⇒ n(C)=0,3 моль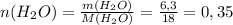 моль ⇒ n(H)=0,7 моль
моль ⇒ n(H)=0,7 моль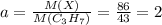
аммиак NH3 весит 17... сравниваем с другими
Н2О = 18 , значит аммиак легче и всех других
HCl =36.5
NH4NO3= 80
HNO3 =63
Ca=40
O2=32
CuO =64
NaCl = 58,5
NH3 + H2O < => NH4OH
NH3 + HCl => NH4Cl
NH3 + HNO3 => NH4NO3
4NH3 + 5O2 => 4NO + 6H2O
все. больше ни с чем не реагирует