1. ca(oh)2 + 2nacl = CaCl2 2naoh
caso4 + 2hcl = cacl2 + h2so4
2. ca(oh)2 + hcl = cacl2 + h2o
3. находятся в 1 группе главной подгруппе(А), очень мягкие при комнатных температура, можно резать ножом. легкоплавкие, легкие. на последней орбитале имеют 1 электон.
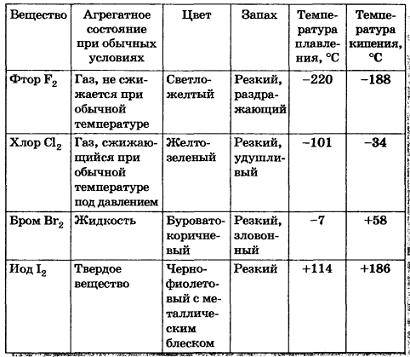
4. щелочные металлы - твердные, галогены - газы(летучие). В твердом состоянии Р2, Сl2, Вг2,I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами (см. вложение)
5. Практическое значение имеют главным образом Na2 SO4 (в технике часто называемый просто сульфат) и K2 SO4 , особенно первый из них. Важнейшим их потребителем является стекольная промышленность. Кристаллогидрат Na2 SO4 ·10H2 O («мирабилит», или «глауберова соль») применяется в медицине как слабительное.
___
Фтор применяют для синтеза фтороуглеродов - фреонов (они используются как хладоагенты и для распыления аэрозолей - красок, лаков и т.д.), химически стойких материалов - тефлонов (-CF2-CF2-). Фториды металлов находят применение при изготовлении оптических элементов - призм, фильтров, волоконных проводов для оптоэлектронной связи.
Хлор используют при получении хлоридов металлов и неметаллов (например, AlCl3 , FeCl3,, PCl3 и т.д.), соляной кислоты, различных хлорорганических соединений: растворителей - тетрахлорметана CCl4, трихлорэтилена CHCl-CCl2, антисептиков и инсектицидов - ДДТ (дихлородифенилтрихлорэтана), лекарственных препаратов (хлоральгидрата - снотворного, гексахлорафена - бактерицидного вещества), отбеливателей.
Бром и иод применяют в фотографии (галогениды серебра, свинца), при получении присадок к бензину (С2H4Br2), ингибиторов воспламенения, в галогенных лампах.
2) 2Al+6HCl=2AlCl3+3H2↑
3) Fe+NaOH≠
4) Al+6NaOH+6H2O=2Na3[Al(OH)6]+3H2↑
Химическое количество всего водорода в первых двух реакциях составит: n(H2)=V/Vm=8.96/22.4=0.4 моль
а в реакции 4 выделился водород n(H2)=V/Vm=6.72/22.4=0.3 моль
Тогда химическое количество n(Al)=n(H2)/3 = 0.3/3=0.1 моль (по коэффициентам в уравнении реакции 4)
Т.к. количество металлов в смеси один и два одинаковое, то определим химическое количество водорода в реакции 2:
n(H2)=n(Al)*3/2=0.1*3/2=0.15 моль
Значит в реакции 1 n(H2)=n(H2)всего-n(H2) в реакции 2=0,4-0,15=0,25 моль
Тогда n(Fe)=n(H2)=0.25 моль (по коэффициентам в уравнении реакции 1)
Рассчитаем массы металлов:
m(Fe)=n*M=0.25*56=14 г
m(Al)=n*M=0.1*27=2.7 г
m(смеси)=m(Fe)+m(Al)=14+2,7=16,7 г
рассчитаем массовые доли металлов в смеси:
w(Fe)=m(Fe)/m(смеси) *100%=14/16.7*100%=83.83%
w(Al)=m(Al)/m(смеси)*100%=2.7/16.7*100%=16.17%