Привет! Сейчас решим
Классический подтвердить наличие соляной кислоты - это реакция с нитратом серебра.
AgNO3 + HCl = AgCl + HNO3
Ag⁺ + NO3⁻ + H⁺ + Cl⁻ = AgCl + H⁺ + NO3⁻
Ag⁺ + Cl⁻ = AgCl Выпадение белого творожистого осадка.
BaCl2 + H2SO4 = 2HCl + BaSO4
Ba²⁺ + 2Cl⁻ + 2H⁺ + SO4²⁻ = 2H⁺ + 2Cl⁻ + BaSO4
Ba²⁺ + SO4²⁻ = BaSO4 (белый осадок)
4HNO3 + Cu = Cu(NO3)2 + 2NO2 +2H2O (при нагреве)
4H⁺ + 4NO3⁻ + Cu⁰ = Cu²⁺ + 2NO3⁻ + 2NO2 + 2H2O
2NO3⁻ + Cu⁰ + 4H⁺ = Cu²⁺ + 2NO2 + 2H2O (образование синего раствора и бурого газа)
Готово!
Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
ответ: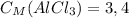 моль/л
моль/л