№6 формула сильного электролита в водном растворе (В) HNO3
№7 Среда раствора в результате гидролиза карбоната аммония (А) щелочная
№8 сокращенное ионное уравнение реакции
Zn2++2OH=Zn(OH)2↓ (С) ZnCL2(p-p) и NaOH(p-p)
№9 для получения водорода в лаборотории обычно используется взаимодействие
(В) цинка с соляной кислотой
№10 масса щелочи, которую необходимо растворить в 50 г воды для приготовления 10% раствора, равна
(А) 5,6г
№11 коэффициент перед формулой окислителя в уравнении реакций, схема которой
S+HNO3→H2SO4+NO равен (В) 2
№12 реактивом на хлорид-ионы является (D) нитрат серебра
№13 вещества с общей формулой CnH2n+2 относятся к классу (А) алканов
№14гомологом ацетилена является (В) 4-метилпентин-1
№15 для алкенов характерны реакции (В) присоединения
№16 одним из реагентов для получения этанола может являться (В) этилен
№17перегонка нефти производится с целью получения (С) различных нефтепродуктов
1.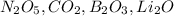
2. 4,7 г образца - это 100%, а
х г золота в нем___58,5%, откуда х=4,7*58,5/100=2,7 г
Чтобы определить количество вещества,то нужно массу поделить на молярную массу:
v(Au)=m(Au)/M(Au)=2,7/197=0,01 моль
3.
10 г, х г 20 г у г
63 г 40 г 85 г
1. Сначала определим,какое из исходных веществ прореагировало полностью(без остатка),приняв одно из них за Х,например,масу кислоты:
для полной нейтрализации 63 г кислоты необходимо 40 г гидроксида, а
для --//--//-- х г___________________20 г, откуда х=63*20/40=31,5 г
2. Как видим,полностью прореагирует кислота,вот по ее массе и найдем массу соли:
при взаимодействии 63 г кислоты образуется 85 г соли, а
при --//--//-- 10 г_________________у г, откуда у=85*10/63=13,5 г