1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.
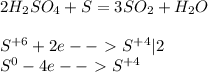
Записываем выражение для криоскопической константы растворителя:
Ккр = (Т2 - Т1)/М, в нашем случае изменение температуры равно 0 - ( - 0,93) = 0.93,
криоскопическая константа для воды равна 1,86.
Выражаем М
М = 0,93/1,86 = 0,5 моль на 1000 г воды.
По условию на 1000 г воды приходится 4*1000/100 = 40 граммов вещества
Следовательно, 1 моль вещества весит 40*2 = 80 г.
ответ: 80 г
Если не правильно я не виновата
Объяснение: