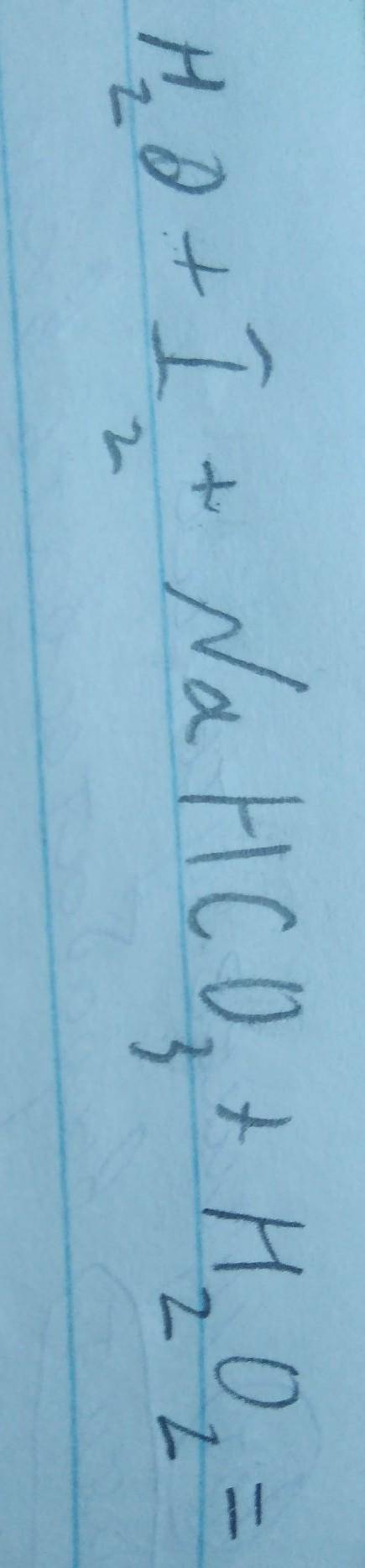
a)CuCl2- подвергается гидролизу так как образовалась от слабого гидроксида и сильной кислоты
CuCl2=Cu(2+) + 2Cl(-)
Cu(2+) +HOH=Cu(OH)2 + H(-). гидролиз по катиону,среда кисла,лакмус меняется на красный цвет
б))NaNO3 гидролиза нет так как образовалась от сильной кислоты и сильного гидроксида(среда нейтральная)
с)Mg(CH3COO)2 гидролиз есть так как образовалась от слабой кислоты и слабого гидроксида
Mg(CH3COO)2=Mg(2+) + 2CH3COO(-)
1.Mg(2+) + HOH=Mg(OH)2 + H(-)
2.2CH3COO(-) + 2HOH = 2CH3COOH + OH(+)
гидролиз по аниону и по катиону, цвет лакмуса не меняется, среда нейтральная
N₂(г)+3H₂(г)⇄2NH₃(г) + Q
Химическое равновесие зависит – от концентрации, давления, температуры.
Используем выводы, сделанные ученым ЛЕ-ШАТАЛЬЕ, который определил направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
И, наоборот, увеличить концентрацию образования продуктов реакции равновесие смещается в сторону исходных веществ:
N₂(г)+3H₂(г)←2NH₃(г) + Q
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции (реакция образования аммиака эндотермическая).
При повышении температуры равновесие сместится в сторону реакции разложения аммиака:
а) N₂(г)+3H₂(г)←2NH₃(г) + 92,4 кДж (экзотермическая – выделение тепла).
3) Влияние давления (только для газообразных веществ) – при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём:
4 объема→2объема
N₂(г)+3H₂(г)→2NH₃(г) + 92,4 кДж
Он не решается
Объяснение: