Cu(OH)2 -> CuO + H2O(разложение) (Над стрелкой подписать знак температуры)
CuO + SO3 -> CuSO4(соединение)
CuSO4 + 2KOH(недостаток) -> Cu(OH)2 + K2SO4(обмен)
Cu(2+) + SO4(2-) + 2K(+) + 2OH(-) -> Cu(OH)2 + 2K(+) + SO4(2-)
Cu(2+) + 2OH(-) -> Cu(OH)2
В скобках указаны заряды ионов, их следует подписать справа сверху от формулы иона.
Объяснение:
Первая реакция превращения гидроксида меди (II) Cu(OH)2 в оксид меди (II) CuO является стандартной реакцией разложения нерастворимого гидроксида. Нерастворимые гидроксиды под температурой разлагаются на оксид соответствующего элемента и воду.
Вторая реакция - тоже стандартная реакция взаимодействия кислотного (SO3) и основного (CuO) оксидов с образованием соли.
Третья реакция - реакция обмена, в ходе которой катионы "меняются" своими анионами, то есть катион первого вещества присоединяет анион второго, и наоборот - катион второго вещества присоединяет анион первого. Реакция из-за того, что в ходе образуется нерастворимый гидроксид меди (II) Cu(OH)2. Гидроксид калия KOH следует добавлять в недостатке, так как гидроксид меди (II) Cu(OH)2 является амфотерным, то есть может реагировать как с кислотами, так и с основаниями.
Полное ионное уравнение составляется так:1)В левую часть уравнения выписываются все ионы, которые существуют в растворе (образуются из-за растворения и диссоциации реагентов в растворителе (вода))2) В правой части в молекулярной форме записыВ записанном полном ионном уравнении "сокращаются" ионы, то есть не пишутся все ионы, которые были в продуктах, но после протекания реакции так и остались в растворе. Иначе говоря, в левой части оставляются только ионы образующие выпадающий(е) осадок(ки), выделяющий(е)ся газ(ы), не диссоциирующее(ие) вещество(а) (как, например, вода), а в правой части - соответственно осадок(ки), газ(ы), или вода.вае(ю)тся выпадающий(е) осадок(ки), выделяющий(е)ся газ(ы), не диссоциирующее(ие) вещество(а) (как, например, вода).3) В правую часть в ионном виде записываются все оставшиеся в растворе ионы, соблюдая материальный баланс. Краткое ионное уравнение записывается так:
Уравнение реакции:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
1) Дан раствор соляной кислоты - HCl, дано процентное содержание кислоты в растворе, дана масса раствора. Дано это все не просто так, рассчитаем массу кислоты в растворе.
m(HCl) = w*m(р-ра) =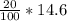 = 2.92грамм
= 2.92грамм
2) Рассчитаем количество вещества кислоты:
По уравнению реакции:
3)Рассчитаем массу известняка:
m(CaCO3) = n(CaCO3)*M(CaCO3) = 0,04моль*100г/моль = 4грамма
ответ: масса известняка растворившаяся при взаимодействии его с раствором соляной кислоты равна 4 грамма