
Задача №1
- Уравнение:
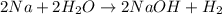
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
Mg⁰+HN⁺⁵O₃(конц.≥80%)→Mg⁺²(NO₃)₂+N⁺⁴O₂+H₂O
Mg⁰-2e⁻→Mg⁺² 2 1
2
N⁺⁵+e⁻→N⁺⁴ 1 2
Mg+4HNO₃(конц.≥80%)=Mg(NO₃)₂+2NO₂+2H₂O
Mg⁰+HN⁺⁵O₃(конц.45%-75%)→Mg⁺²(NO₃)₂+N₂⁺O+H₂O
Mg⁰-2e⁻→Mg⁺² 2 4
8
2N⁺⁵+2x4e⁻→2N⁺ 8 1
4Mg+10HNO₃(конц.45%-75%)=4Mg(NO₃)₂+N₂O+5H₂O
Mg⁰+HN⁺⁵O₃(конц.∠5%)→Mg⁺²(NO₃)₂+N⁻³H₄NO₃+H₂O
Mg⁰-2e⁻→Mg⁺² 2 4
8
2N⁺⁵+8e⁻→2N⁻³ 8 1
4Mg+10HNO₃(конц.∠5%)=4Mg(NO₃)₂+NH₄NO₃+3H₂O
Pb⁰+HN⁺⁵O₃(конц.)→Pb⁺²(NO₃)₂+N⁺⁴O₂+H₂O
Pb⁰-2e⁻→Pb⁺² 2 1
2
N⁺⁵+e⁻→N⁺⁴ 1 2
Pb+4HNO₃(конц.)=Pb(NO₃)₂+2NO₂+2H₂O
Pb⁰+HN⁺⁵O₃(разб.)→Pb⁺²(NO₃)₂+N⁺²O+H₂O
Pb⁰-2e⁻→Pb⁺² 2 3
6
N⁺⁵+3e⁻→N⁺² 3 2
3Pb+8HNO₃(разб.)=3Pb(NO₃)₂+2NO+4H₂O
количества СО 2 получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например, мрамора, мела или соды с соляной кислотой.