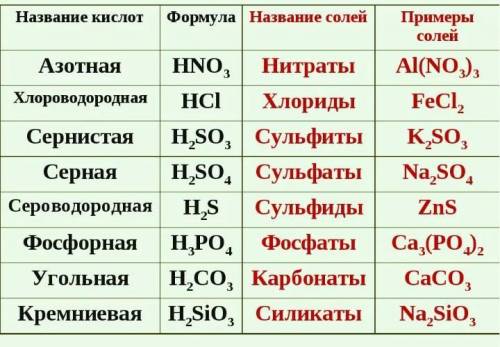
1Соли сернистой кислоты называются сульфитами. Как кислота двухосновная, она образует соли двух типов, например; NaHS03 - бисульфит натрия и Na2S03 - сульфит натрия.. Соли сернистой кислоты , образованные катионами сильных оснований, в водных растворах имеют щелочную реакцию.
3 Гидролиз солей — это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита -кислоты (или кислой соли), или основания (или основной соли). Слово «гидролиз» означает разложение водой («гидро»-вода, «лизис» — разложение)


Заряд ядра, количество протонов- определяются по порядковому номеру элемента, у лития он равен 3 , следовательно заряд ядра и количество протонов равен 3.(Литий (Li) )
число протонов, электронов, равно номеру химического элемента число нейтронов атомная маса элемента - (минус) порядковый номер Mg р+ = 12; е- = 12; n 0 = 24-12 = 12 S р+ = 16; е- = 16; n 0 = 32-16= 16.(Магний (Mg))
Число протонов как и число электронов равно порядковому номеру, т. е. 24. Нейтроны же находятся как 52-24=28.(Хром (Cr))
Серебро с атомным номером 47. Соответственно что заряд его ядра равен +47 и 47 электронов. . а ядро состоит из протонов и нейтронов, причем их количество равно (судя по моим старым знаниям по химии. . 10 лет соответственно по 47
Pb (свинец) заряд ядра 82 кол-во р=82 кол-во е=82 кол-во n=125 B(бор)заряд ядра 5 кол-во р=5 кол-во е=5 кол-во n=6 P (фосфор) заряд ядра 15 кол-во р=15 кол-во е=15 кол-во n=16
Заряд ядра определяется по порядковому номеру элемента. Бром 35, значит заряд ядра 35. Число протонов и электронов тоже равно порядковому номеру, т.е. у Брома это 35.
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3 . Число внешних электронов определяется номером группы И равно 4 .
Объяснение:
Амфотерные гидроксиды – вещества, состоящие из металла (цинка, алюминия и некоторых других) и гидроксогрупп OH.
Могут быть получены действием щелочей на растворы солей цинка в зависимости от условий проявлять как основные, так и кислотные свойства. Т.е. реагируют как с кислотами, так и со щелочами.
С кислотами амфотерные гидроксиды реагируют так же, как и основания, с образованием соли и воды. Например, гидроксид цинка, нерастворимый в воде, взаимодействует с соляной кислотой и осадок исчезает:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
(полученная соль – хлорид цинка)
Чтобы записать реакцию гидроксида цинка со щелочью, его удобно записать, как кислоту – водород в начале.
Осадок растворяется и в избытке щёлочи.
При взаимодействии гидроксида цинка со щелочами образуются соли – цинкаты:
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
Строго говоря, образование цинката натрия в водном растворе происходит при участии гидроксид-ионов, но обычно для простоты записывают это уравнение.
Нерастворимые гидроксиды разлагаются при нагревании, образуется оксид металла и вода:
Zn(OH)2 = ZnO + H2O