Объяснение:
ВОТ ОТВЕТ УКАЗАН НА ФОТОГРАФИИ ЕСЛИ ХОТИТЕ МОЖЕТЕ ПОДПИСАТЬСЯ Я БУДУ ЗНАТЬ ЧТО ВЫ ЗАДАЁТЕ ВОПРОС И СРАЗУ ЖЕ ПОСТАРАЮСЬ НА НЕГО ОТВЕТИТЬ
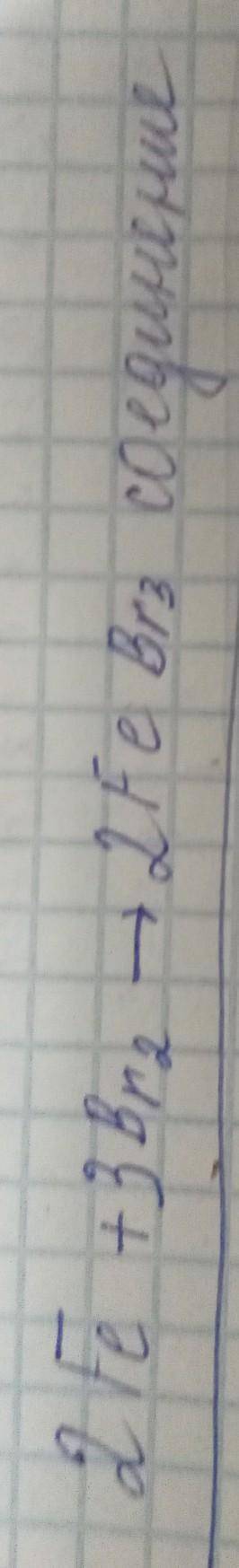
ГИДРОМЕТАЛЛУРГИЯ (от греч. hydor — вода и metallurgeo — добываю руду, обрабатываю металлы).
Процессы извлечения металлов из руд путем выщелачивания их растворителями с последующим осаждением из растворов, в большинстве случаев в металлическом состоянии и реже в форме химических соединений. При этом осаждение производится:
1) цементацией,
2) электролизом,
3) реагентами (в форме химического соединения),
4) адсорбцией
5) восстановлением на угле.
Гидрометаллургия (мокрый путь извлечения) имеет наибольшее значение для получения следующих металлов: золота, серебра, цинка и меди. Кроме того, гидрометаллургия применяется при извлечении платины, никеля и ртути.
Своеобразные процессы, относимые обычно к области химической технологии, но по существу являющиеся гидрометаллургическими, применяются:
1) при производстве оксида алюминия, перерабатываемой затем путем электролиза с получением чистого алюминия.
2) при извлечении редких металлов в форме химических соединений. Растворителями являются растворы солей, кислот и щелочей..
Напишем реакцию
Na₂SO₄ + H₂SO₄ = 2NaHSO₄
Посчитаем сколько сульфата натрия в растворе: m(Na₂SO₄) = w(Na₂SO₄) * m(раствора) = 0.22 * 128.1 = 28.2 г
Посчитаем какое это количество вещества: n(Na₂SO₄) = m(Na₂SO₄) / M(Na₂SO₄) = 28.2 / 142 = 0.2 моль
По уравнению реакции столько же и серной кислоты. Посчитаем ее массу: m(H₂SO₄) = n(H₂SO₄) * M(H₂SO₄) = 0.2 * 98 = 19.6 г
Посчитаем сколько это 30%-ного раствора: m(раствора) = m(H₂SO₄) / w(H₂SO₄) = 19.6 / 0.3 = 65.3 г
Значит в конце мы получили: 128.1 + 65.3 = 193.4 г раствора
Посчитаем сколько там гидросульфата натрия зная, что его количество 0.4 моль: m(NaHSO₄) = n(NaHSO₄) * M(NaHSO₄) = 0.4 * 120 = 48 г
Если в 128.5 г насыщенного раствора есть 28.5 г соли, то в 193.4 г насыщенного раствора есть х г соли, отсюда: x = 193.4 * 28.5 / 128.5 = 42.9 г
Значит все остальное выпало в осадок, а это: 48 - 42.9 = 5.1 ≈ 5 г
Объяснение:
2Fe + 3Br2 = 2FeBr3 (соединение)