Для того чтобы получить нитрат кальция к азотной кислоте можно прибавить кальций или гидроксид кальция(без разницы):
2HNO3 + Ca=Ca(NO3)2 + H2
Для начала найдем массу вещества азотной кислоты, для этого умножим массу раствора на массовую долю:
m(вещества)=200*0,063=12,6 г
Затем узнаем количество азотной кислоты, для этого массу вещества делим на молярную массу азотной кислоты:
n(HNO3)=12,6/63=0,2 моль
Для того чтобы найти выход продукта, нужно знать теоретическую массу, ее мы находим умножив количество нитрата кальция на его молярну массу(количество будет в 2 раза меньше, по коэффициентам в уравнении:
m(теоретическая)=0,1*164=16,4 г
Чтобы узнать выход надо практическую массу поделить на теоретическую:
ω=15/16,4*100%=91,5%
1. а) сначала необходимо найти массу нитрата в первом растворе:
m(AgNO3)=m1(раствора)*w1(AgNO3)=60*0,6=36 г
б) теперь определим массу нового раствора,после добавления воды:
m2(раствора)=m1(растворара)+m(H2O)=60+40=100 г(г с мл смешивать нельзя,но учитывая,что плотность воды равна 1 г/мл,поэтому 40 мл численно равно 40 г воды)
в)теперь,отнеся массу соли(так как она не изменилась) к массе нового раствора и получим вторую массовую долю:
w2(AgNO3)=m(AgNO3)/m2(раствора)=36/100=0,36 или 36%
х моль 11,2 л
2.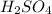 →
→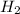
1 моль 22,4 л
При взаимодействии 1 моль кислоты выделяется 22,4 л водорода, а
при -- // -- х моль___________________11,2 л, откуда
х=1*11,2/22,4=0,5 моль