При отсутствии в условии ошибок ("выделился водород объемом 6.72 л", а не "смесь газов объемом 6.72 л"), напрашивается след-ий вариант решения: n SiO2 = 24/60=0.4 моль, n Mg = 28.8/24=1.2 моль, ур-е р-ии в соот-ии с условиями задачи: 2Mg + SiO2 = 2MgO + Si;
магний нах-ся в избытке равном 1.2-(0.4*2)=0.4 моль и теоретически в р-ии с соляной к-ой по ур-ю Mg + 2HCl = MgCl2 + H2 должен выд-ся водород объемом 22.4*0.4=8.96 л, фактически же выд-ся объем 6.72 л (6.72/22.4=0.3 моль) , т. е. в магнии нах-ся примеси с м. д. равной ((0.4-0.3)/1.2)*100=8.33%;
Объяснение:
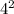 -+молекула воды.Б. 1. Mg(OH)2+H2SO4=Mgso4+2H20. OH-+H+=молекула воды. 2. Mg (OH2)+SO3=MgSO4+МОЛЕКУЛА ВОДЫ. SO3+2OH-=МОЛЕКУЛА ВОДЫ+SO2-4. 3. H2SO4+NA2O=NA2SO4+H2O/ NA20+2H+=2NA+ =H2O.
-+молекула воды.Б. 1. Mg(OH)2+H2SO4=Mgso4+2H20. OH-+H+=молекула воды. 2. Mg (OH2)+SO3=MgSO4+МОЛЕКУЛА ВОДЫ. SO3+2OH-=МОЛЕКУЛА ВОДЫ+SO2-4. 3. H2SO4+NA2O=NA2SO4+H2O/ NA20+2H+=2NA+ =H2O.
1 будет 101
Объяснение:
Остальное честно я не знаю