Начнем с алюминия.
Алюминий - элемент третьей группы, главной подгруппы - металл, значит он будет отдавать электроны, сам при этом окисляясь.
Алюминий - простое вещество.
Спокойно сгорает на воздухе, реагирует с галогенами, при нагревании с фтором, азотом, фосфором и углеродом.
Уравнения важнейших реакций:
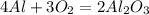 (t = 700
(t = 700 )
)
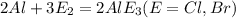 - почему я вынес, да потому что, с этими веществами обозначенными буквой Е, алюминий реагирует при комнатной ремпературе.
- почему я вынес, да потому что, с этими веществами обозначенными буквой Е, алюминий реагирует при комнатной ремпературе.
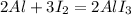 - эта реакция, с йодом - идет при катализаторе
- эта реакция, с йодом - идет при катализаторе
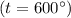
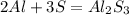
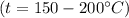
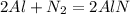

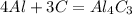
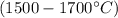
P.S. Если нужны реакции с соединениями алюминия, пиши в ЛС
Теперь кальций
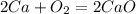
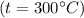
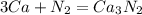
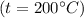
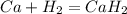
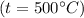
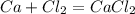
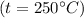
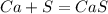
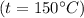
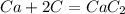
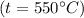
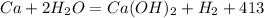 кДж
кДж
P.S. Если нужны будут реакции с соединениями кальция - обращайся)
Натрий
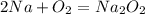 - натрий, как любой уважающий себя щелочной металл (кроме лития) образует оксид не сразу, сначала - пероксид
- натрий, как любой уважающий себя щелочной металл (кроме лития) образует оксид не сразу, сначала - пероксид
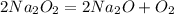 - реакция идет в вакууме, при высоких температурах
- реакция идет в вакууме, при высоких температурах
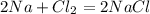
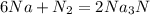
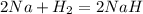
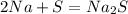
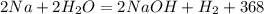 кДж
кДж
P.S. Если нужны реакции с соединениями - пиши
И последнее железо - 2 или 3
Сейчас будем разбираться, когда железо - 2, а когда - 3
Если на железо действует сильный окислитель - галогены, концентрированные серная кислота и разбавленная азотная кислота то железо - 3:
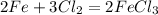
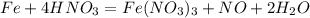
Если на железо действует слабый окислитель - хлороводород, разбавленная серная кислота, сера, то железо - 2
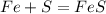
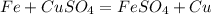
P.S. все то же)))
Собственно понимать тут мало чего надо, если не понимаешь, лучше заучить)
CH3COOK соль образована CH3COOH(слабая к-та) и KOH(сильное основание)
OH(-)>H(+)
PH>7 ЩЕЛОЧНАЯ СРЕДА
лакмус-синий
метилоранж-желтый
фенофталеин-малиновый
ZnSO4 соль образована H2SO4(сильная к-та) и Zn(OH)2(слабое основание)CH3COOK+H20=CH3COOH+KOH
H(+)>OH(-)
PH<OH КИСЛАЯ СРЕДА
1)2Zn(2+)+2H20=2H(+)+2ZnOH(+)
2)2Zn(2+)+2SO4(2-)+2H2O=2H(+)+SO4(2-)+2ZnOH(+)+SO4(2-)
3)2ZnSO4+2H2O=H2SO4+(ZnOH)2SO4
Al(NO3)3 соль образована HNO3(сильная к-та) и Al(OH)3(слабое основание)
H(+)>OH(-)
PH<OH КИСЛАЯ СРЕДА
1)Al(3+)+H2O=AlOH(2+)+H(+)
2)Al(3+)+3NO3(-)+H2O=AlOH(2+)+2NO3(-)+H(+)+NO3(-)
3)Al(NO3)3+H2O=AlOH(NO3)2+HNO3
лакмус-красный
метилоранж-розовый
ф/ф-бесцветный
рщ9щдрзррща
щгдрлуг4щ35х6азе6щ5к