Извини, но в первом вопросе могу подсказать только это:
1.Простые вещества – вещества состоящие из одного вида атомов. Просты вещества делются на металлы и неметаллы. Металлы, например, Zn(цинк), Li(литий), Na(натрий), имеют такие физические свойства как :
металлический блеск;
- тепло-, электропроводны
- пластичны
- непрозрачны
- твёрдые (исключение ртуть)
Неметаллы, например, H2 (водород), O2 (кислород), С(углерод) имеют такие физические свойства как:
- Бывают во всех агрегатных состояниях
- Не тепло-, электропроводны
- Бывают разных цветов
Сложные вещества – вещества, состоящие из нескольких видов атома.
Сложные вещества делются на
- Оксиды – сложные вещества, состоящие из 2 элементов, один из которых кислород
- Основания – сложные вещества, состоящие из атомов металла и одной или нескольких групп ОН
- Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка
- Соли - сложные вещества, состоящие из атомов металла и кислотного остатка.
Вопрос 2.
Каждый период начинается щелочным металлом и заканчивается благородным газом. В группе сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Соответственно восстановительные свойства усиливаются, а окислительные уменьшаются. Группы делются на главные и подгруппы, соответственно, на А и В. Периоды делятся на малые( I, II, III) и большие (IV, V, VI, VII).
Положение металлов.
Если провести диагональ от B(бора) к At(астату), то левый нижний угол и чётные ряды больших периодов металлы. Каждый период начинается с металла.
Особенности строения атомов.
- небольшое число электронов на внешнем электронном уровне: 1-3.
- относительно большой радиус атома.
Положение неметаллов.
Если провести диагональ от B(бора) к At(астату), то верхний правый угол за исключением чётных рядов больших периодов будут неметаллы.
Особенности строения
- относительно большое число электронов на внешнем электронном уровне
- относительно маленький радиус атома.
Вопрос 4
Атом сотоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Ядро в свою очередь состоит из протонов и нейтронов.
Число электронов и протонов определяем по порядковому номеру элемента. Число нейтронов определяем по формуле атомную массу минус порядковый номер.
Электроны в атоме имеют разную энергию, то есть находятся на разных энергитических уровнях. Число уровней равно номеру периода.

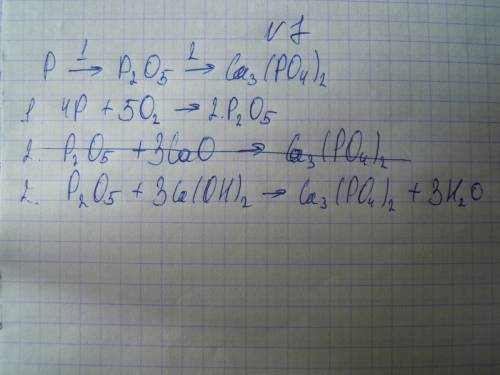
1. m(SO2) = 32 g M(SO2) = 32 + 16*2 = 64 g/mol
n = m/M = 32 / 64 = 0.5 mol
m(CO2) = 50g M(CO2) = 12 + 2 * 16 = 44 g/mol
n=m/M = 50 / 44 = 1.136 mol
m(CrO3) = 80g M(CrO3) = 52 + 3*16 = 100 g/mol
n=m/M = 80 / 100 = 0.8 mol
2. m(Li2O) = 54 g M(Li2O) = 7 * 2 + 16 = 30 g/mol
n=m/M=54 / 30 = 1.8 mol
N = Na * n = 1.8 * 6 * 10^23 = 10.8 / 10^23
m(N2O3) = 32 g M(N2O3) = 14 *2 + 16 * 3 = 76 g/mol
n=m/M=32/76 = 0.421 mol
N=Na*n = 0.421 * 6 * 10^23 = 2.526 * 10^23
3. N(CO2) = 20 * 10^23
n=N/Na = 20 * 10^23 / 6 / 10^23 = 3.333 mol
V = Vm * n = 22.4 * 3.333 = 74.66 l
M(CO2) = 12 + 16 * 2 = 44 g/mol
m = n * M = 3.333 * 44 = 146.6652 g
4. V(H2) = 67.2 l
n = V / Vm = 67.2 / 22.4 = 3 mol
M(H2) = 2 * 1 = 2 g/mol
m=n*M = 3 * 2 = 6 g
Протектором должен быть более активный металл чем свинец. Магний будет служить наилучшей протекторной защитой. У магния низкий потенциал -2,37В. Гальваническая пара магний - свинец будет иметь наибольшую разность потенциалов.
При атмосферной коррозии на поверхности магниевого протектора протекает процесс:
2Mg -4e⁻ = 2Mg²⁺
Электроны по проводнику переходят на свинцовый кабель и на поверхности свинца происходит кислородная деполяризация:
О₂ + 2Н₂О + 4e⁻= 4ОН⁻
Продуктом атмосферной коррозии будет гидроксид магния:
2 Мg⁺ + 4ОН⁻ = 2Мg(ОН)₂
5.ков.связь образована атомами.
существует два вида связи ков. полярная и ков. неполярная
ков.полярная образована атомами разных неметалов,а ков. неполярная образована атомами одинаковых неметалов