Объяснение:
Используя метод электронного баланса, составьте уравнения реакции. Укажите окислитель и восстановитель, а также процесс окисления и восстановления.
2KMnO4 + 5H2S + 3H2SО4 = 2MnSO4 + 5 S + K2SO4 + 8H2O
Mn(+7) + 5e = Mn+2 восстановление, KMnO4 - окислитель ║2
S(-2) -2e = S(0) окисление, H2S - восстановитель ║5
3FeSO4 + 2KClO3 + 12KOH = 3K2FeO4 + 2KCl + 3K2SO4 + 6H2O
Fe2+ -4e = Fe+6 окисление, FeSO4 - восстановитель ║ 3
Сl+5 + 6e = Cl(-1) восстановление, KClO3 - окислитель ║ 2
8Na + 5H2SO4(конц) = 4 Na2SO4 + H2S↑ + 4H2O
Na - 1e = Na+ окисление Na - восстановитель ║8
S+6 + 8e = S(-2) восстановление, H2SO4 - окислитель ║1
Объяснение:
Используя метод электронного баланса, составьте уравнения реакции. Укажите окислитель и восстановитель, а также процесс окисления и восстановления.
2KMnO4 + 5H2S + 3H2SО4 = 2MnSO4 + 5 S + K2SO4 + 8H2O
Mn(+7) + 5e = Mn+2 восстановление, KMnO4 - окислитель ║2
S(-2) -2e = S(0) окисление, H2S - восстановитель ║5
3FeSO4 + 2KClO3 + 12KOH = 3K2FeO4 + 2KCl + 3K2SO4 + 6H2O
Fe2+ -4e = Fe+6 окисление, FeSO4 - восстановитель ║ 3
Сl+5 + 6e = Cl(-1) восстановление, KClO3 - окислитель ║ 2
8Na + 5H2SO4(конц) = 4 Na2SO4 + H2S↑ + 4H2O
Na - 1e = Na+ окисление Na - восстановитель ║8
S+6 + 8e = S(-2) восстановление, H2SO4 - окислитель ║1
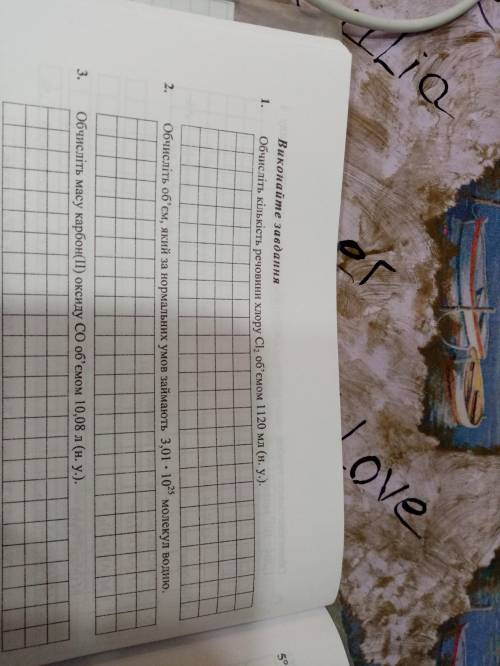
Объяснение:
1) n(Cl2) = V(Cl2) / Vm = 1,12 л / 22,4 л/моль =0,05 моль
2) n(H2) = N(H2) / Na = 3,01*10²⁵ / 6,02*10²³ = 50 моль
V(H2) = Vm *n = 22,4 л/моль * 50 моль =1120 л
3) n(CO) = V(CO)/ Vm = 10,08 л / 22,4 л/моль =0,45 моль
m(CO) = n * M = 0,45 * 28 =12,6 г