Сгорание в чистом кислороде:
4Fe+3O2=2Fe2O3
Горение в хлоре:
2Fe+3Cl2=2FeCl3
Взаимодействие раскалённого железа с водяным паром:
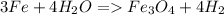
С соляной кислотой:

Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании:
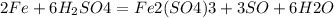
Окисление:Fe − 3e− = Fe3+Восстановление:SO42− + 4H+ + 2e− = SO2 + 2H2O
3SO42− + 12H+ + 2Fe = 3SO2 + 6H2O + 2Fe3+- сокр ионное
Восстановление:2H+ + 2e− = H2 Окисление:Fe − 2e− = Fe2+ 2H+ + Fe = H2 + Fe2+ -сокр. ионное
Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей:
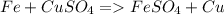
1. Химический элемент, имеющий схему строения атома +14 2, 8, 4, в
Периодической системе занимает положение:
1. 4-й период, главная подгруппа III группа;
2. 2-й период, главная подгруппа I группа;
3. 3-й период, главная подгруппа IV группа;
4. 3-й период, главная подгруппа II группа.
2. Строение внешнего энергетического уровня 3s
элемента:
1. магния 2. серы 3. фосфора 4. хлора
3. Элемент с наиболее ярко выраженными неметаллическими свойствами:
1. кремний 2. магний 3. сера 4. фосфор
4. Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
1. Э2О 2. ЭО 3. ЭО2 4. ЭО3
5. Характер свойств высшего оксида химического элемента с порядковым
номером 7 в Периодической системе:
1. амфотерный 2. кислотный 3. основной
6. Основные свойства наиболее ярко выражены у гидроксида:
1. бария 2. бериллия 3. кальция 4. магния
7. Схема превращения Cu+2→ Cu0
1. CuO + H2 = Cu + H2O
2. Cu + Cl2 = CuCl2
3. CuO + 2HCl = CuCl2 + H2O
4. 2Cu +O2 = 2CuO
8.Сокращенное ионное уравнение
реакции Ba2+
соответствует взаимодействию:
1. бария и раствора серной кислоты;
3. оксида бария и раствора серной
кислоты;
2. оксида бария и соляной кислоты;
4. хлорида бария и раствора серной
кислоты.
соответствует атому
23p
3
соответствует химическому уравнению:
+ SO4
= BaSO4↓
2-
9. Формула вещества, реагирующего
с раствором гидроксида кальция
1. HCl 2. CuO
3. H2O 4. Mg
10. Элементом Э в схеме
превращений Э → ЭО2 → Н2ЭО3
является:
1. азот 2. магний
3. алюминий 4. углерод
Часть Б. Задания со свободным
ответом.
11. ( ) Напишите
уравнения реакций между
растворами гидроксида элемента
с порядковым номером No3 и
водородного соединения элемента
с порядковым номером No9 в
Периодической системе. Назовите
все вещества, укажите тип реакции.
12. ( ) По схеме
превращений BaO → Ba(OH)
2 → BaCO3 → BaCl2, составьте
уравнения реакций в
молекулярном виде.
Для
превращения No3 запишите полное
и сокращенное ионные уравнения.
13. ( ) По уравнению
реакции 2Mg + O2 = 2MgO
рассчитайте объем кислорода
(н.у.), необходимого для полного
сгорания 1,2 г магния
1
2HCl+CaCO³=CO²+H²O+CaCl²
Найдём количество CaCO³
n=m/M
m(CaCO³)=1000 гр.
M(CaCO³)=40+12+16*3=100 гр/моль
n(СаСО³)=1000/100=10 моль
Найдем количество HCl.
m=n*M
В реакции перед HCl стоит цифра 2, а перед CaCO³ стоит цифра один, из этого следует что нам соляной кислоты нам надо вдвое больше.
n(HCl)=n(CaCO³)*2=10*2=20 моль
M(HCl)=1+35,5=36,5 гр/моль
m(HCl)=20*36,5*0,3=219 гр.
Найдем объем выделившегося при реакции CO²
По реакции видно, что из одного моль CaCO³ получается 1 моль CO².
Тогда
n(CO²)=n(CaCO³)=10 моль
Так как по условию реакция проведена при н.у. то
Vm(газа)=22,4 л/моль
V=n*Vm
V(СО²)=10*22,4=224 л
ответ: m(HCl)=219 гр; V(СО²)=224 л
Железо реагирует с простыми веществами неметаллами и со сложными проявляя свойства восстановителя:
1) раскаленное железо с парами воды образует оксид железа:
0 -2 t +2 0
Fe + H2O > FeO + H2↑
1| Fe[0] -2e = Fe[+2] | восстановитель, окисление
1| 2H[+1] +2e = H2[0] | окислитель, восстановление
2) Железо реагирует с хлором:
0 0 +3-1
2Fe + 3Cl2 > 2FeCl3
2| Fe[0] -3e = Fe[+3] | восстановитель, окисление
2| Cl2[0] +2e = 2Cl[-1] | окислитель, восстановление
3) Железо во влажном воздухе покрывается ржавчиной:
0 +1-2 0 +3-2 +1
4Fe + 6H2O + 3O2 > 4Fe(OH)3
4| Fe[0] -3e = Fe[+3] | восстановитель, окисление
3| O2[+1] +4e = 2O[-2] | окислитель, восстановление
4) Железо реагирует с кислотами разбавленными:
0 +1-1 +2-1 0
Fe + 2HCl > FeCl2 + H2↑
1| Fe[0] -2e = Fe[+2] | восстановитель, окисление
1| 2H[+1] +2e = H2[0] | окислитель, восстановление
5) Железо взаимодействует с солями менее активных металлов:
0 +2 -1 0 +2 -1
Fe + CuCl2 > Cu + FeCl2
1| Fe[0] -2e = Fe[+2] | восстановитель, окисление
1| Cu[+2] +2e = Cu[0] | окислитель, восстановление
6) железо сплавляется с серой:
0 0 +2-2
Fe + S --- > FeS
1| Fe[0] -2e = Fe[+2] | восстановитель, окисление
1| S[0] +2e = S[-2] | окислитель, восстановление
И по заданию с серной кислотой:
0 +1+6-2 +2+6-2 0
Fe + H2SO4 > FeSO4 + H2
1| Fe[0] -2e = Fe[+2] | восстановитель, окисление
1| 2H[+1] +2e = H2[0] | окислитель, восстановление