СuSO₄ + 2NaOH = Cu(OH)₂осадок + Na₂SO₄
1)Сначала надо выяснить, какое вещество нам дано в избытке. Для этого найдем массы чистых безводных веществ:
ω = m(вещества)÷m(раствора)×100% ⇒ m(вещества)= ω×m(раствора÷100%
m(СuSO₄)= 10×80÷100%= 8 г
m(NaOH)= 20×160÷100%= 32 г - избыток
2) Поскольку гидроксида натрия получилось в избытке, то расчет по уравнению реакции надо проводить по сульфату меди:
Молярные массы:
М (СuSO₄)= 160 г/моль
M (Сu(ОН)₂)= 98 г/моль
160 г СuSO₄ дают 98 г Сu(ОН)₂
8 г СuSO₄ дают х г Сu(ОН)₂
⇒ х= 8×98÷160= 4,9 г Сu(ОН)₂
ответ: образуется 4,9 г осадка.
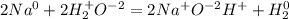 Пример неОВР:
Пример неОВР: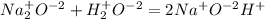 По кол-ву выделяемого или поглощаемого тепла делят на экзотермические и эндотермические: Пример эндотермической реакции:
По кол-ву выделяемого или поглощаемого тепла делят на экзотермические и эндотермические: Пример эндотермической реакции: 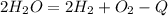 Пример экзотермической реакции:
Пример экзотермической реакции: 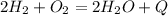 По числу и составу исходных веществ и продуктов делят на реакции соединения, разложения, замещения и обмена. Пример реакции соединения:
По числу и составу исходных веществ и продуктов делят на реакции соединения, разложения, замещения и обмена. Пример реакции соединения: 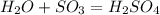 Пример реакции разложения:
Пример реакции разложения: 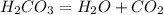 Пример реакции замещения:
Пример реакции замещения:  Пример реакции обмена:
Пример реакции обмена: 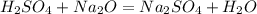
H2SO4(конц)+Mg=MgSO4+H2
Mg+HNO3(конц)=Mg(NO3)2+H2
10HNO3(разб)+Mg=4Mg(NO3)2+N2O+5H2O
2Mg+Cu(NO3)2=2Mg(NO3)2+Cu