1) Серная кислота реагируют с: MgO, NaOH, BaCl, Zn.
Реакция обмена и в ионном виде: 2NaOH + H2SO4 -> Na2SO4 + 2H2O
2Na(+) + 2OH(-) + 2Н(+) + SO4(2-) -> 2Na(+) + SO4(2-) + 2H2O
2OH(-) + 2H(+) -> 2H2O
2) Задание на фото
3) N2 + 3H2 -> 2NH3 + Q
a) реакция соединения
б) экзотермическая
в) обратимая
г) каталитическая
д) ОВР
е) гомогенная
При увеличении температуры химическое равновесие сместиться в сторону исходных веществ.
При увеличении давления химическое равновесие сместиться в сторону продуктов
4) Задание на фото

І.Выберите три верных ответа. С водородом реагируют оба вещества в наборах: 1,3,5
ІІ.1.Сначала определим массу соли в первоначальном растворе:
m1(соли)=m1(раствора)*w1(соли)=100*0,15=15 г
2.Узнаем массу соли в новом растворе,сложив уже имеющуюся(ту,что только что определили) и добавленную:
m(соли)=m1(соли)+m2(соли)=15+50=65 г
3.Вычислим массу нового раствора,сложив массу первоначального раствора с массой добавленной соли:
m2(раствора)=m1(раствора)+m2(соли)=100+50=150 г
4. Отнеся массу соли в новом растворе к массе этого раствора,получим массовую долю соли в новом растворе:
w2(соли)=m(соли)/m2(раствора)=65/150=0,43 или 43%
ІІІ.
+7 -1 +2 0
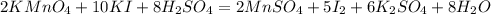
+7 +2
Mn + 5e = Mn|2| окислитель(восстановление)
-1 0
2I - 2e = I2 |5| восстановитель(окисление)
IV.
4488 г х л
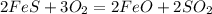
176 г 44,8 л
1. Определим чистую массу сульфида в образце:
5610 г образца - это 100%,
у г_______________80%, откуда у=5610*80/100=4488 г
2. По этой массе,подставив ее в уравнение реакции,определим объем сернистого газа:
при взаимодействии 176 г сульфида образуется 44,8 л сернистого газа, а
при --//--//-- 4488 г__________________Х л, откуда=
х=4488*44,8/176=1142 л или 1,142 м в кубе
Семиречья
Объяснение: