Объяснение:
3MgCl2 + 2H3PO4 = Mg3(PO4)2↓ + 6HCl
3Mg(2+) + 6Cl(-) + 6H(+) + 2PO4(3-) = Mg3(PO4)2↓ + 6H(+) + 6Cl(-)
3Mg(2+) + 3PO4(3-) = Mg3(PO4)2↓
3Mg(NO3)2 + 2Na3PO4 = Mg3(PO4)2 ↓+ 6NaNO3
3Mg(2+) + 6NO3(-) + 6Na(+) + 2PO4(3-) = Mg3(PO4)2↓ + 6Na(+) + 6NO3(-)
3Mg(2+) + 2PO4(3-) = Mg3(PO4)2↓
3MgSO4 + 2K3PO4 = Mg3(PO4)2↓ + 3K2SO4
3Mg(2+) + 3SO4(2-) + 6K(+) + 2PO4(3-) = Mg3(PO4)2↓ + 6K(+) + 3SO4(2-)
3Mg(2+) + 2PO4(3-) = Mg3(PO4)2↓
3MgI2 + 2(NH4)3PO4 = Mg3(PO4)2↓ + 6NH4I
3Mg(2+) + 6I(-) + 6NH4(+) + 2PO4(3-) = Mg3(PO4)2↓ + 6NH4(+) + 6I(-)
3Mg(2+) + 2PO4(3-) = Mg3(PO4)2↓
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
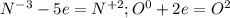 (1-(окисление азота) и (восстановление кислорода)
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем 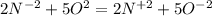 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
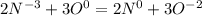 ,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
2) Тип связи определяем по разнице электроотрицательностей атомов элементов в соединении. Если больше 1,8, то ионная, меньше - ковалентная полярная, если 0, то ковалентная неполярная
MgCl2 (ионная), N2 (ков. неполярная), HBr (ков. полярная).
Молекула азота состоит из двух атомов, между ними тройная связь.
N≡N. Одна сигма и две пи-связи за счет образования пар с неспаренными р-электронами с каждого атома
3) Магний имеет порядковый номер 12. Это означает, что у каждого изотопа по 12 протонов и электронов.
Число нейтронов = атомная масса - 12
Соотв. для каждого атома магний-24,25 и 26 число нейтронов будет 12,13 и 14
4) Кислоты: , H2SO4 (серная), HNO3 (азотная)
Соли: NaCl (хлорид натрия), FeCl3 (хлорид железа (III)), K2SO4 (сульфат калия)
Основания: КОН, NaOH (гидроксиды калия и натрия)
5) LiCl --> Li(+) + Cl(-)
Na2SO4 --> 2Na(+) + SO4(2-)
KNO3 --> K(+) + NO3(-)
Ba(OH)2 --> Ba(2+) + 2OH(-)
6) Са3(РО4)2: Ca(+2), P(+5), O(-2)
7) Р2О5 - HPO3, H3PO4
N2O3 - HNO2
CaO - Ca(OH)2
8) 6,02 * 1023 молекул углекислого газа СО2 - это 1 моль, 22,4л или 44г (молярная масса) СО2
9)
а) Cu(OH)2 --> CuO + H2O (разложение)
б) 2HCl + Mg --> MgCl2 (замещение)
в) CO2 + CaO --> CaCO3 (соединение)
г) NaOH + HNO3 --> NaNO3 + H2O (обмен)
10) Уравнение реакции
CuSO4 + 2NaOH --> Cu(OH)2 + Na2SO4
Осадок Cu(OH)2.
n(CuSO4) = n(Co(OH)2) = 0,1 моль
Масса осадка: 0,1моль*(64+(16+1)*2) = 9,8 (г)
11) Уравнение реакции
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
Масса карбоната кальция = 0,8*100г = 80 г
Его количество вещества = 80г / 100г/моль = 0,8 моль
По реакции n(CO2) = n(CaCO3) = 0.8 моль
V(CO2) = 0,8моль * 22,4 л/моль = 17,92 л
m(CO2) = 0,8моль*44г/моль = 35,2 г
12) AgNO3 + NaCl --> AgCl + NaNO3
AgNO3 + HCl --> AgCl + HNO3
13) 2Cu(0) + O2(0) --> 2Cu(+2)O(-2)
Cu(0) - 2e --> Cu(+2) окисление
O2(0) + 4e --> 2O(-2) восстановление
CuO + 2HCl --> CuCl2 + H2O
CuCl2 + 2NaOH --> Cu(OH)2 + 2NaCl
Cu(OH)2 + H2SO4 --> CuSO4 + 2H2O
Cu(OH)2 + 2H(+) + SO4(-2) --> Cu(+2) + SO4(-2) + 2H2O
Cu(OH)2 + 2H(+) --> Cu(+2) + 2H2O
14) Ионы CO3(-2) определяют с кислот по выделению углекислого газа. Например,
CO3(-2) + 2H(+) --> CO2 + H2O
Na2CO3 + 2HCl --> CO2 + H2O + 2NaCl