1. Тип химической связи в соединении Н2О: в) ковалентная полярная
2. Наиболее электроотрицательный химический элемент: б) Cl
3. Заряд иона кальция: а) 2+
4. Завершенный внешний электронный слой имеет атом химического элемента: а) Не
5. Число общих электронных пар между атомами в молекуле О2 равно:
б) 2
О=О
6. Ковалентная неполярная связь образуется между:
а) атомами одного неметалла
7. Сущность ионной связи состоит:
а) в электростатическом притяжении между разноименными зарядами
(ионами)
8. Электроотрицательность химических элементов в периодах с увеличением порядкового номера элемента:
а) увеличивается
9. К правильным утверждениям относятся:
а) соединяясь между собой, атомы стремятся к достижению устойчивого состояния
г) между калием и хлором образуется ионная связь
10. В периоде слева направо радиус атома и металлические свойства
соответственно: г) уменьшается и уменьшаются
11. Внешний уровень считается завершенным (кроме водорода и гелия), если на нем:
тогда г) 8 электронов
12. Образование молекулы водорода из атомов, можно изобразить:
г) H • + • H → H •• H
13. В какой молекуле тройная связь? а) N2
14. Выберите элемент с переменной валентностью:
а) Cl
15. При образовании ковалентной полярной связи электронная пара:
г) смещена к более электроотрицательному элементу
16. В каком соединении валентность железа равна III?
в) Fe2O3
17. Ковалентная полярная связь образуется между:
в) различными атомами неметаллов
18. В ряду элементов: Al Si P S: ?????
а) увеличивается число электронных слоев в атомах;
б) усиливаются неметаллические свойства;
в) уменьшается число внешних электронов в атомах;
г) возрастают радиусы атомов.
19. Напишите электронную и электронно-графическую формулы для атома Са.
+20 ) ) ) ) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s₂
2882
Укажите валентность элемента = II.
20. Запишите электронные и графические схемы образования молекулы HCl..
в фото
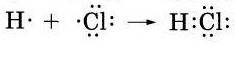
1.
Серная кислота проявляет окислительные свойства, так как сера в этом соединении с максимальной для неё степенью окисления +6
H2S - проявляет восстановительные свойства, здесь у серы низшая ст. о. -2
SO3 - проявляет только окислительные свойства, ведь также у серы +6
--
3.
H2SO3 + H2S --> S + H2O / у S была ст. оксиления +4, стала 0. Но если посмотреть в левую часть, там у сероводорода сера имеет ст. оксиления -2, и тоже изменяется на 0. Больше никаких изменений ст. оксилений нет, т.е. сера одновременно и окислитель, и восстановитель.
это схема окисл.-восст. реакции (ОВР)
цифры получаем (и додумываем, если понадобится), пользуясь такой схемой:
S(+4) +4e --> S(0) / общее кратное 4*2=8 / 2
S(-2) -2e --> S(0) / 8 мы делим на e / 4
H2SO3 + H2S --> 2S + H2O
перед S в правой части уравнения уже смело можно ставить 2.
H в левой 4, в правой 2
O в левой 3, в правой 1 из этого ставим 3 перед H2O
H2SO3 + H2S --> 2S + 3H2O
теперь снова считаем водород, в правой стало 6, т.е. перед H2S 2 ставим.
H2SO3 + 2H2S --> 2S + 3H2O
ну вот вроде и всё, остальное аналогично ))