K₂SiO₃ + Ca(NO₃)₂ = CaSiO₃ + 2KNO₃
Поскольку нитрат кальция нам дан в избытке, то K₂SiO₃ прореагирует полностью.
1) Найдем массу чистого (без примесей) K₂SiO₃:
20,53 г - это 100%
х г - это 15%
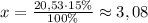 г K₂SiO₃
г K₂SiO₃
M(K₂SiO₃)= 154 г/моль
M(CaSiO₃)= 116 г/моль
m(K₂SiO₃)= 3,08 г
m(CaSiO₃)= y г
2) Через расчет по уравнению реакции найдем массу образовавшегося осадка (CaSiO₃).
154 г K₂SiO₃ дают 116 г CaSiO₃
3,08 г K₂SiO₃ дают у г CaSiO₃
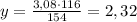 г CaSiO₃
г CaSiO₃
ответ: масса образовавшегося осадка равна 2,32 г.
w(массовая доля)=mв-ва/mр-ра;
Примем массу гидроксида за х, подставим в формулу по определению массовой доли растворенного вещества и получим уравнение:
0,00037=х/х+200г;
х=0,00037(х+200)
х=0,00037х+0,074
х-0,00037х=0,074
0.99963х=0,074
х=0,074:0,99963=0,074
Теперь,подставив в уравнение массу гидроксида,определим массу оксида:
у г 0,074 г
CaO + H2O = Ca(OH)2
56 г 74 г
при взаимодействии 56 г оксида образуется 74 г гидроксида, а
при у г - 0,074г отсюда:
у=56*0,074/74=0,056 г
ответ:m(CaO)=0,056г
K2SiO3+Ca(NO3)2=CaSiO3+2KNO3
1)m(K2SiO3)=w(K2SiO3)*m(раствора)=0.15*20.53=3.08
2)n(K2SiO3)=m(K2SiO3)/M(K2SiO3)=3.08/154=0.02
3)n(K2SiO3)=n(CaSiO3)=0.02
4) m(CaSiO3)=M(CaSiO3)*n(CaSiO3)=116*0.02=2.32