Буду рад даже если ответите хотябы на один вопрос. 1. составить уравнение окислительно-восстановительных реакций протекающих по схеме 1)zn +hno3 --> zn(^2+)+n2o+h2o 2)zn+hno3 --> zn(^2+)+no2+h2o уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакции 2. составить уравнение окислительно-восстановительных реакций протекающих по схемам mncl2+kocl+koh--> mno2+kcl+h2o уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакции 3. написать молекулярные и сокращенные ионные уравнение реакций cuso4+na2s--> cuso4+naoh--> k2s+hcl записать выражение пр и к и их численные значение труднорастворимых веществ и слабых электролитов. 4. составить уравнения окислительно-восстановительных реакций, протекающих по схемам: 1)al +hno3(разб.) --> al3+ n2+h2o 2)al+hno3(> al^(3+)+no2+h2o уравнять электронно-ионным рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакции 5. рассчитать эдс гальванического элемента. zn/znso4//feso4/fe указать анод и катод. написать процессы на аноде и катоде. условия стандартные. 6. написать молекулярные и ионные уравнения гидролиза соли fecl2. как изменится характер среды? 7. с молекулярных и ионных уравнений реакций раскрыть амфотерный характер гидроксида sn(oh)2. к.ч. -4 8. na2s+hoi --> s + nai+naoh уравнять электронно-ионным рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакций 9. написать уравнение диссоциации h2po4 и fe(oh)3 по ступеням. составить выражения констант диссоциации. 10. составить уравнения окислительно-восстановительных реакций протекающих по схемам: 1)zn +hno3(разб.) --> zn^(2+)+n2o+h2o 2) zn+hno3(> zn^(2+)+no2+h2o уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакций. 11. составить уравнения окислительно-восстановительных реакций, протекающих по схемам: kmno4+h2so4+na2so3--> mn2+…+… so4^(2-)+… уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакций. 12. какие процессы протекают при электролизе im раствора nicl2? электроды никелевые. обосновать расчетом. 13. написать молекулярные и ионные уравнения реакций: 1)al(oh)3+hcl--> 2)al(oh)3+naoh--> к.ч. -4 14.составить уравнения окислительно-восстановительных реакций, протекающих по схемам: kmno4+h2o+na2so3--> mno2+…so4^(2-)+… уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекании реакций. 15. рассчитать потенциал электрода: zn/znso4, 0,01m. 16. составить уравнения окислительно-восстановительных реакций, протекающих по схемам: na2s+nano2+h2so4--> s+no+… уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекания реакций. 17. рассчитать потенциал электрода: fe/fe2+ , 0,0001 m. 18. составить уравнения окислительно-восстановительных реакций, протекающих по схемам: al+naoh+h2o--> h2+… уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекания реакций. 19. какие процессы протекают при электролизе im раствора zaso4. электроды цинковые. обосновать расчётом. 20. написать молекулярные и ионно-молекулярные уравнения реакций. 1) zncl2+koh(> 2) cdso4+koh--> 21. применяя уравнение гиббса, определить термодинамическую возможность реакции: nb2o3+5ca=2nb+5cao (k) (k) (k) (k) при стандартных условиях. 22. с молекулярных и ионных уравнений раскрыть амфотерный характер pb(oh)2(^2).к.ч. =4 23. составить уравнение окислительно-восстановительных реакций, протекающих по схемам: 1) ni+hno3 (> 2) ni+h2so4(> 3) ni+hcl--> уравнять электронно-ионным методом. рассчитать эдс и сделать вывод о возможности самопроизвольного протекания реакций. 24. написать выражения констант диссоциации по ступеням для h2so4 и ca(oh)2. 25. применяя уравнение гиббса, рассчитать термодинамическую возможность реакции: 2ch4-c2h2+3h2 (г) (г) (г) при стандартных условиях.
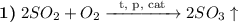
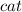 - катализатор (кат). Например:
- катализатор (кат). Например: 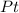 , или
, или 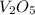 , или
, или 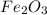 .
.
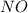 - оксид азота (II) / монооксид азота / окись азота
- оксид азота (II) / монооксид азота / окись азота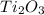 - оксид титана (III) / трЁхокись титана
- оксид титана (III) / трЁхокись титана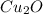 - оксид меди (I) / оксид димеди / закись меди / гемиоксид меди / куприт
- оксид меди (I) / оксид димеди / закись меди / гемиоксид меди / куприт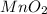 - оксид марганца (IV) / диоксид марганца / пиролюзит
- оксид марганца (IV) / диоксид марганца / пиролюзит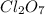 - оксид хлора (VII) / дихлоргептаоксид / хлорный ангидрид
- оксид хлора (VII) / дихлоргептаоксид / хлорный ангидрид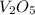 - оксид ванадия (V) / пентаоксид диванадия
- оксид ванадия (V) / пентаоксид диванадия 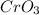 - оксид хрома (VI) / триоксид хрома / трЁхокись хрома / хромовый ангидрид
- оксид хрома (VI) / триоксид хрома / трЁхокись хрома / хромовый ангидрид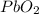
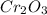
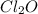
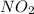
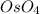
1.
1)Zn +HNO3 -->Zn(^2+)+N2O+H2O
2)Zn+HNO3 -->Zn(^2+)+NO2+H2O
1)Zn (0) + H(+1)N(+5)O3(-2) ---> Zn(+2) + N(+1)O(-2)+H2O
Zn(0) -2e Zn (+2) 2 4 2
N(+5) +4eN(+1) 4 2 1
2)
Zn(0) -2e Zn (+2) 2 1
N(+5) +1eN(+4) 1 2