1 ) H2O ; O2; H3PO4; PCI3; FE2O3; AGNO3.
2) K2SiO3 Mr=39*2+28+48=154
3)Наиболее слабо связаны с ядром электроны ,расположенные на последнем энергетическом уровне,т к ядро может отдавать электроны только с внешнего уровня.А если оно может их отдавать ,то следовательно связь слабая.
4)Главная подгруппа состоит из элементов малых периодов.Побочная подгруппа состоит из элементов больших периодов.
5)Период — последовательность атомов по возрастанию заряда ядра и заполнению электронами внешнего электронного уровня.
Группа- последовательность атомов по возрастанию заряда ядра , обладающих однотипным электронным строением.
6)Металлические свойства элементов в главных подгруппах ,с увеличением относительных атомных масс, увеличиваются. А у побочных наоборот уменьшаются.
Неметаллические свойства элементов главных подгрупп с увеличением порядкового номера уменьшаются. А у побочных ,наоборот,увеличиваются.
1. C2H5NH2COOH + HCl = NH3ClC2H5COOH
2. 2NH2CH2COOH + 2Na = 2NH2CH2COONa + H2
3. NH2C3H7COOH + C2H5OH (t>140°,h2so4(k))= NH2C3H7COOC2H5 + H2O
4. NH2CH2COOH + NH2C2H5COOH = NH2CH2CONHC2H5COOH + H2O
5. NH2C2H5COOH + KOH = NH2C2H5COOK + H2O
6. 1) C6H6 + OHNO2(k) (h2so4(k))= C6H5NO2 + H2O
2) C6H5NO2 + 3H2 (kat)= C6H5NH2 + 2H2O
3) C6H5NH2 + 3Br2 = C6H2Br3NH2 + 3HBr
7. 1) C2H5OH + CuO (t)= CH3COH + Cu + H2O
2) CH3COH + Ag2O (t,NH3*H2O)= CH3COOH + 2Ag
3) CH3COOH + Cl2 ((CH3COO)3Co)= CH2ClCOOH + HCl
4) CH2ClCOOH + 2NH3 = CH2NH2COOH + NH4Cl
8. C6H5NH2 + OHNO2 (k)= C6H4NH2NO2 + H2O
9. C6H5NH2 + HCl = [C6H5NH3]Cl
1)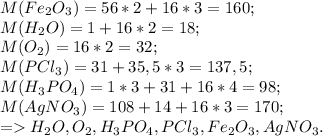
2) формула: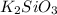
молярная масса: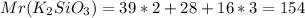
3) Валентные или электроны внешних электронных оболочек, потому что они наиболее удалены от ядра. К тому же если они не заполнены полностью, такой атом вступает в хим.реакции.
4) Главная подгруппа содержит элементы малых и больших периодов, а побочная - только больших.
Также главную подгруппу составляют s- и p-элементы, а побочную подгруппу -- d-элементы.
5) В главных подгруппах с увеличением относительных атомных масс, усиливаются
металлические свойства элементов.
Неметаллические свойства у элементов главных подгрупп с увеличением порядкового номера ослабевают. (у побочных наоборот)