1. Если 1000 мл воды содержит 200 мг гидрокарбоната, то
250 мл________________х мг, откуда х=250*200/1000=50 мг или 0,05 г
0,05 г х г
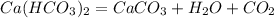
162 г 100 г
При разложении 162 г гидрокарбоната выпадает 100 г карбоната, а
при -- // -- 0,05 г_______________________у г, откуда
у=0,05*100/162=0,03 г или 30 мг
2. Примем массу гидроксида за Х, подставим в формулу по определению массовой доли растворенного вещества и получим уравнение:
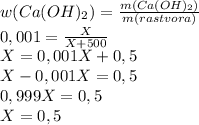 г
г
Теперь,подставив в уравнение массу гидроксида,определим массу оксида:
у г 0,5 г
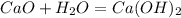
56 г 74 г
при взаимодействии 56 г оксида образуется 74 г гидроксида, а
при -- // -- у г_________________0,5 г, откуда
у=56*0,5/74=0,38 г
792 г 10 моль,х моль у л

88 г 2 моль 22,4 л
1. Определим чистую массу сульфида в образце,учитывая,что массовая доля его в нем - 90%(100-10=90):
m(FeS)=m(образца)*w(FeS)=880*0,9=792 г
2. Теперь определим,какое из исходных веществ прореагирует полностью(без остатка),приняв,например, количество вещества соляной кислоты за Х:
для полного взаимодействия 88 г сульфида необходимо 2 моль кислоты, а
для -- // -- 792 г___________________х моль, откуда
х=792*2/88=18 моль
3. Как видим,что кислота прореагирует полностью,значит объем сероводорода рассчитываем по количеству вещества кислоты:
при взаимодействии 2 моль кислоты образуется 22,4 сероводорода, а
при -- // -- 10 моль_________________у л, откуда
у=10*22,4/2=112 л
2KMnO4 →t°→ O₂↑ + MnO₂ + K₂MnO4
4Al + 3O₂ → 2Al₂O₃