Раставим ступени окисления:
Zn, S - простые вещества, степень окисления равен 0
Водород и кислород обычно проявляют степень окисления +1 и -2 соответсвенно.
Расчитываем степень оеисления S в молекуле кислоты - сумма положительных и отрицательных степеней окисления должна быть равно 0. Кислород дает -8, водород — +2. Значит сера будет +6 (+6 + +2+ -8=0)
В реакции меняется ступень окисления только в цинка и серы, обозначим только их
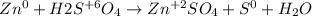
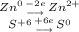
Общее кратное равно шести, значит чтобы уравнить баланс электронов нужно умножить верхнее уравнение на 3
получим 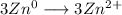
подставим коефициенты в исходное уравнение, уравняем его чтобы количество атомов до и после было одинаково
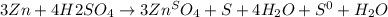
Но
3S + 2Al (t) = Al2S3 в этой реакции сера восстанавливается, значит, она - окислитель
S + O2 = SO2 в этой реакции сера окисляется, значит, она восстановитель.
Кроме того, многие металлы (и неметаллы тоже) в промежуточных степенях окисления обладают двойственностью.
PbO + CO = Pb + CO2 здесь свинец (степень окисления +2) восстанавливается, он -окислитель
2PbO + O2 = 2PbO2 свинец (cтепень окисления +2) окисляется, он - восстановитель
Вещества, в которых элемент имеет промежуточную степень окисления, могут проявлять свойства как окислителей, так и восстановителей.