Cu + H2SO4(конц)= CuSO4 + SO2↑ + H2O
Cu(0) + H(+1)2S(+6)O(-2)4(конц.) → Cu(+2)S(+6)O(-2)4 + H(+1)2O(-2) + S(+4)O(-2)2↑
Cu(0) - 2e -> Cu(+2) окиснення відновник
S(+6) + 2e -> S(+4) відновлення окисник
Cu(0) + S(+6) -> Cu(+2) + S(+4)
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
S + H2SO4(конц.) = SO↑2 + H2O
S(0) + H(+1)2S(+6)O(-2)4 = S(+4)O(-2)2↑ + H(+1)2O(-2)
2 H2SO4 + S → 3 SO2 ↑ + 2 H2O
Это окислительно-восстановительная реакция:
S(0) - 4 e- → S(+4) (окисление)
2 S(6+) + 4 e- → 2 S(+4) (восстановле́ние)
S является восстановителем, H2SO4 является окислителем.
(...)- коефіцієнти окислення, пишуться зверху біля хімічних елементів
Объяснение:
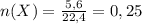 моль
моль
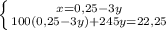
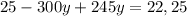

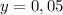
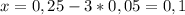
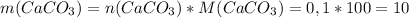 г
г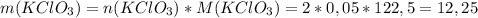 г
г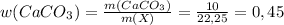 или 45%
или 45% или 55%
или 55%
Кислоты различаются по основности: Основность определяется количеством атомов водорода, входящим в их состав. Например, серная - H2SO4 - двухосновная, так как в её состав входит 2 атома водорода.
Основные химические свойства кислот:
- взаимодействие с металлами:
H2SO4 +Zn = ZnSO4 + H2 - Образуется соль и выделяется водород
В зависимости от концентрации самой кислоты получаются различные продукты химической реакции.
Например, 2H2SO4 + Cu = CuSO4 + SO2 +2H2O - в этом случае серная кислота - концентрированная. Разбавленная - на медь (Cu) никак не действует.
- взаимодействие с основными оксидами и амфотерными оксидами:
CuO + H2SO4 = CuSO4 + H2O - образуется соль и вода;
SnO + HCl = SnCl2 + H2O (оксид олова - SnO - амфотерный оксид)
- взаимодействие с основаниями и щелочами:
HCl + KOH = KCl + H2O - эту реакцию ещё называют реакцией нейтрализации -образуется соль и вода;
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
- взаимодействие с солями:
уравненияSO3 + H2O = H2SO4;
CO2 + H2O = H2CO3;