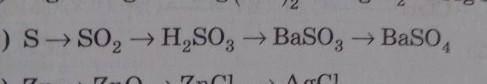
Первые сведения о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости. В тридцатых годах XIX в. опыты выдающегося физика М. Фарадея навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Модель Томсона
Первая модель строения атома была предложена Дж. Томсоном в 1904 г., согласно которой атом – положительно заряженная сфера с вкрапленными в нее электронами. Несмотря на свое несовершенство томсоновская модель позволяла объяснить явления испускания, поглощения и рассеяния света атомами, а также установить число электронов в атомах легких элементов.
Модель Резерфорда
Эта модель строения атома известна как планетарная, т. к. электроны вращаются вокруг ядра подобно планетам солнечной системы .
Модель Бора
Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию.
Объяснение:
N2 + O2 = 2NO
N2(0) -4e = 2N(+2) 1 ок-ие
в-ль
O2(0) +4e = 2O(-2) 1 в-ие
ок-ль
3Mg + N2 = Mg3N2
Mg(0) -2e = Mg(+2) 3 ок-ие
в-ль
N2(0) +6e = 2N(-3) 1 в-ие
ок-ль
Cl2 + 2KBr = 2KCl + Br2
Cl2(0) +2e = 2Cl(-) 1 в-ие
ок-ль
2Br(-) -2e = Br2 (0) 1 ок-ие
в-ль
Fe + CuSO4 = FeSO4 + Cu
Fe(0) -2e = Fe(+2) 1 ок-ие
в-ль
Cu(+2) +2e = Cu(0) 1 в-ие
ок-ль
2Na + 2H2O = 2NaOH + H2
Na(0) -1e = Na(+) 2 ок-ие
в-ль
2H(+) +2e = H2(0) 1 в-ие
ок-ль
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2N(+5) +2e = 2N(+4) 2 в-ие
ок-ль
2O(-2) -4e = O2(0) 1 ок-ие
в-ль
Fe + H2SO4 = FeSO4 + H2
Fe(0) -2e = Fe(+2) 1 ок-ие
в-ль
2H(+) +2e = H2(0) 1 в-ие
ок-ль
5Cl2 + 2P = 2PCl5
Cl(0) +1e = Cl(-) 10 в-ие
ок-ль
P(0) -5e = P(+5) 2 ок-ие
в-ль