5 г х г
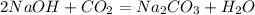
80 г 106 г
1. Сначала найдем чистую массу гидроксида в растворе(просто умножив массу раствора на массовую долю гидроксида в нем):
m(NaOH)=m(раствора)*w(NaOH)=20*0,25=5 г
2. Подставив эту массу в уравнение реакции,и получим массу соли(карбоната натрия):
при взаимодействии 80 г гидроксида получается 106 г карбоната, а
при --//--//-- 5 г_____________________х г, откуда
х=106*5/80=6,625 г
V (NH3) = 6,72л
w (NH4Cl) = 80% = 0,8
Vm = 22,4 л/моль
Найти:
m (NH4Cl) - ?
Решение:
NH3 + HCl → NH4Cl
n (NH3) = V/Vm = 6,72/22,4 = 0,3 моль
n (NH3) относится к n (NH4Cl), как 1:1 =>
n (NH4Cl) = 0,3 моль
M (NH4Cl) = 14 + 1*4 + 35,4 = 53 г/моль
m (NH4Cl) = n * M = 53 * 0,3 = 15,9 г (это m(теор))
Однако, по условию задачи, мы должны найти массу, которая получена практическим путём, значит:
m (практ) = m (теор) * 0,8 = 15,9 * 0,8 = 12,72г
ответ: 12,72г