1) Для начала мы запишем схему гальванического элемента:
Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Fe - Анод Au - Катод
A⁻ : Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Fe⁺² - 1e⁻ → Fe⁺³ | 1 | | 2 | - восстановитель E₁° = -0,77 В
| | 2 | |
A⁻ : Au⁺³ + 2e⁻ → Au⁺ | 2 | | 1 | - окислитель E₂° = 1,40 В
2Fe⁺² - 2e⁻ + Au³⁺ + 2e⁻ → 2Fe⁺³ + Au⁺
2Fe⁺² + Au³⁺ → 2Fe⁺³ + Au⁺ - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
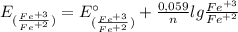
E(Fe⁺³/Fe⁺²) = -0,77 В + 0,059/1 × lg (0,1 моль/л / 10⁻² моль/л) = -0,77 В + 0,059 × lg (0,1 / 0,01) = -0,77 В + 0,059 × lg 10 = -0,77 В + 0,059 × 1 = -0,77 В + 0,059 = -0,711 В
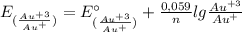
E(Au⁺³/Au⁺) = 1,40 В + 0,059/2 × lg (0,1 моль/л / 10⁻² моль/л) = 1,40 В + 0,0295 × lg (0,1 / 0,01) = 1,40 В + 0,0295 × lg 10 = 1,40 В + 0,0295 × 1 = 1,40 В + 0,0295 = 1,4295 В ≈ 1,43 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Au⁺³/Au⁺) - E(Fe⁺³/Fe⁺²) = 1,43 В - (-0,711 В) = 1,43 В + 0,711 В = 2,141 В
ответ: ε = 2,141 В
Решено от : 
СаСО3+2HCl=CaCl2+H2O+CO2 m(CaCO3)=10г ,что составляет количество вещества n(CaCO3)=10/(40+12+48)=0,1моль столько же получится углекислого газа, масса которого m(CO2)=0,1x(12+32)=4,4г и тогда масса первого стакана m=100+10 - 4,4=105,6г
MgСО3+2HCl=MgCl2+H2O+CO2что составляет количество вещества n(MgCO3)=8,4/(24+12+48)=0,1моль столько же получится углекислого газа, масса которого m(CO2)=0,1x(12+32)=4,4г и тогда масса второго стакана m=100+8,4 - 4,4=104г
Второй стакан на 1,6г легче.