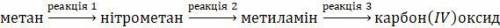
Объяснение:
Если пластины из двух различных металлов опустить в растворы их солей и обеспечить перенос ионов с пористой мембраны или солевого ключа, то мы получим устройство, называемое гальваническим элементом.
(-) Zn │Zn(2+) ║ Cd(2+) │Cd (+)
В нашем случае представлена гальваническая пара Zn/Cd
Более активный металл Zn будет анодом, а менее активный металл кадмий - катодом.
Стандартные электродные потенциалы φ° Сd2+/Cd = - 040, B;
φ° Zn2+/Zn = − 0,76 B.
На аноде: Zn(0) - 2ē = Zn(2+) на катоде Сd(2+) + 2ē = Cd(0)
Токообразующая реакция Zn + Cd2+ = Zn2+ + Cd
Указать, какой галогенид-ион может быть использован как восстановитель для процесса: Fe(3+) + e- --> Fe (2+)
Стандартный потенциал φ° Fe(3/Fe(2+) = 0,77 B,
φº I2(0)/2I(-) = 0,53B
φºCl2(0)/2Cl(-) =1,36B
φºBr2(0)/2Br(-) –1,07 В
Запишем заданную реакцию в ионном виде:
2 Г(-) р + 2Fe(3+) p = Г2(0) + 2Fe(2+) p
где Г - галоген ( Сl, Br, I)
и вычислим эдс реакций с участием галогенов
Для хлорид-ионов 0,77 - 1,36 = - 0,59 В
для бромид-ионов 0,77 - 1,07 = - 0,30 В
для иодид-ионов 0,77 - 0,53 = 0,24 В
Получается, что только иодид-ионы восстанавливают ионы Fe(3+) до Fe(2+) :
Запишем уравнение реакции
2KI (p) + 2FeCl3 (p) = I2 ↓ + 2KCl (р) + 2FeCl2 (p)
Объяснение:
1) 162 г Х л
Mg + 2HBr = MgBr2 + H2
n=2 моль n=1 моль
М = 81 г/моль Vm=22,4 л/моль
m=162 г V = 22,4 л
162 г HBr - Х л Н2
162 г HBr - 22,4 л Н2
V(H2) = 162 * 22,4 / 162 = 22,4 л
49 г Х г
2) Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
n=3 моль n=1 моль
М = 98 г/моль М = 342 г/моль
m=294 г m=342 г
49 г H2SO4 - Х г Al2(SO4)3
294 г H2SO4 - 342 г Al2(SO4)3
m(Al2(SO4)3) = 49 * 342 / 294 = 57 г
1) CH₄ + HNO₃ →t°→ CH₃-NO₂ + H₂O
сумма коэффициентов - 4
2) CH₃-NO₂ + 6H →t°,Ni→ CH₃NH₂ + 2H₂O
сумма коэффициентов - 10
3) 4CH₃-NO₂ + 9O₂ →t°→ 4CO₂ + 10H₂O + 2N₂
сумма коэффициентов - 29