задание 1- Механизм металлической связи В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов.
задание 2-Типичные металлы проявляют восстановительные свойства. К восстановителям относится также водород.
Отдавая электроны, восстановители окисляются. Происходит процесс окисления. При этом степень окисления повышается.
Ионы металлов и неметаллов могут принимать или отдавать электроны в зависимости от их степени окисления (заряда иона).
задание 3- золото серебро платина медь.
задание 4-на первом фото
задание 5- на втором фото
на счет второго я немного не уверена (
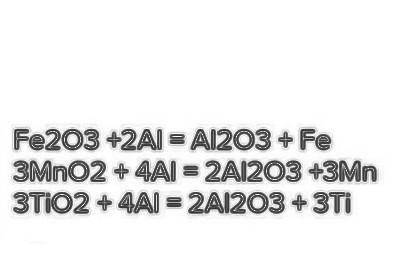
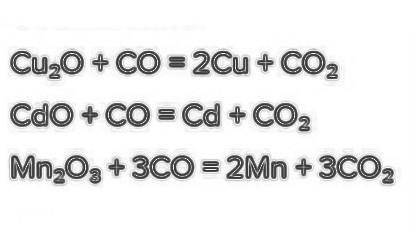
Вариант 1
А1)2
А2)
А3)3
А4)1
А5)2
В1)FeO,K2O,MgO
В2)1)в2)а3)г4)б
B3)CaCl2-хлорид кальция
Na3PO4-фосфат натрия
H2SO4-серная кислота
С1) Mg+2HCl=MgCl2+H2
2LiOH+SO3=Li2SO4+H2O
C2) Оксиды: BaO, SiO, CO2,HgO, SO2, Na2O
Основание: Mg(OH)2, Fe(OH)2, KOH
Кислоты: H3PO4, HCl, H2SO4, HNO3
Соли: СаCl2, Na3PO4
C3) 2Mg+O2=2MgO
MgO+H2O= Mg(OH)2
Mg(OH)2+2HCl= MgCl2 +H2O
Объяснение:
Вариант2
А1)2
А2)4
А3)2
А4)3
А5)3
В1) CO2,Cl2O7, P2O5
B2)1)в2)г3)д4)б
В3) Fe(OH)3 - гидроксид железы(III)
CO2- диоксид углерода
H2SiO3 - кремневая кислота
С1) FeCl3+ 3KOH=Fe(OH)3+3KCl
Ba(OH)2+SO2= BaSO3+Н2
С2) Оксид: Na2O, CO2, HgO, SO2, SiO3
Основание: KOH, Fe(OH)3, Fe(OH)2, KOH
Кислоты: H3PO4, HCl, H2SO4, HNO3
Соли: CaCl2, Na3PO4
C3) 2Mg+O2=2MgO
MgO+H2O= Mg(OH)2
Мg(OH)2+2HCl= MgCl2+H2O
Объяснение:
С1. Составьте уравнение реакции, укажите ее тип и назовите продукты реакции:
А) H2SO4 + 2NaOH = Na2SO4 + 2H2O реакция обмена
= сульфат натрия + вода
Б) AlCl3 + 3LiOH = Al(OH)3 + 3LiCl обмена
= гидроксид алюминия + хлорид лития
В) H2SO4 + CuO = CuSO4 + H2O обмена
= сульфат меди(II) + вода
Г) H2SO4 +Zn = ZnSO4 + H2 замещения, ОВР
= сульфат цинка + водород
Для уравнения: Б)- составьте полное и сокращенное ионные уравнения
Б) AlCl₃ + 3LiOH = Al(OH)₃↓ + 3LiCl
Al³⁺+3Cl⁻ + 3Li⁺ + 3OH⁻ = Al(OH)₃↓ + 3Li⁺ + 3Cl⁻
Al³⁺ + 3OH⁻ = Al(OH)₃↓
Г) составьте электронный баланс найдите окислитель и восстановитель.
H₂⁺SO₄ +Zn⁰ = Zn⁺²SO₄ + H₂⁰
2H⁺ + 2e⁻ = H₂⁰ | 1 - окислитель, процесс восстановления
Zn⁰ - 2e⁻ = Zn⁺² | 1 - восстановитель, процесс окисления
С2. По уравнению реакции Fe(OH)2 = FeO + H2O определите массу оксида железа (II), образовавшегося при разложении 45 г исходного вещества.
Дано:
m(Fe(OH)₂) = 45 г
Найти:
m(FeO)-?
Решение.
М(Fe(OH)₂) = 90 г/моль
n(Fe(OH)₂) = m/M = 45 г/90 г/моль = 0,5 моль
M(FeO) = 72 г/моль
Fe(OH)₂ = FeO + H₂O
Из УХР видно, что n(FeO)=n(Fe(OH)₂
n(FeO) = 0,5 моль
m(FeO) = n*M = 0,5 моль*72 г/моль = 36 г
ответ: 36 г