Дано:
m (бутена) = 100 %;
галоген (обозначим его Г);
m (после р.-ции) = 167,86 %.
Найти:
галоген (Г) — ?
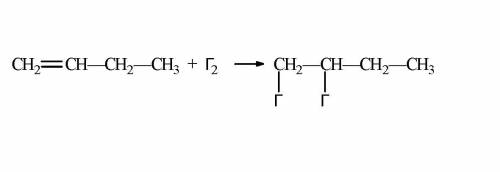
1. Сначала напишем реакцию в общем виде (прикреплена ниже на фото).
2. Затем посчитаем молярную массу бутена. Берём значения из таблицы Менделеева.
M (C₄H₈) = 4 · 12 + 8 = 56 (г/моль).
3. Массу бутена примем за 100%, а массу галогенпроизводного будем считать за 167,86%.
Таким образом мы найдём молярную массу галогенпроизводного.
56 г/моль — 100 %
x г/моль — 167,86 %
x ≈ 94 (г/моль).
4. По уравнению реакции видим, что количество углеродов и водородов не поменялось, но теперь "висят" два радикала галогена.
Значит, от массы галогенпроизводного отнимем "бутен", чтобы у нас остались только галогены, а так как их два, разделим на 2 и узнаем молярную массу искомого галогена.
M (Г) = (94 г/моль – 56 г/моль) ÷ 2 = 19 (г/моль).
Смотрим по таблице Менделеева... это фтор (F)!
ответ: фтор (F).
Cоль образована сильным основанием Ba(OH)2 и слабой кислотой H2S.
Поэтому, пойдёт гидролиз по аниону. Т.к. заряд сульфид-иона 2- (S2-), гидролиз пойдет в 2 ступени (стадии).
BaS → Ba2+ + S2-
I ступень.
S2- + HOH → HS- + OH- (т.к. в растворе накапливаются гидроксид-ионы, среда – щелочная)
Ba2+ + S2- + HOH→ HS- + OH- + Ba2+
2BaS + 2H2O → Ba(HS)2 + Ba(OH)2
II ступень
HS-+ HOH → H2S + OH- (среда – щелочная)
Ba2+ + HS-+ HOH → H2S + OH- + Ba2+
Ba(HS)2 + 2H2O → 2H2S + Ba(OH)2
Итоговое уравнение гидролиза сульфида бария:
BaS + 2H2O → 2H2S↑ + Ba(OH)2
РH > 7
Теоретически вроде гидролиз должен протекать.Однако на практике данная соль AgNO3 гидролизу не подвергается ,это связано вероятнеее всего со специфическими свойствами иона Ag+
Гидролиза не происходит,среда нейтральная.