Дано:
m(Cu)=59г.
m(раствора HNO₃)=120г.
ω%(HNO₃)=15%
Vm=22,4л./моль
V(NO)-?
1. M(Cu)=64г./моль, n₁(Cu)=m(Cu)÷ M(Cu)=54г.÷64г./моль=0,8моль
2. Определим массу азотной кислоты в растворе 120г с массовой долей 15%:
m(HNO₃)=ω%(HNO₃)×m(раствора HNO₃)÷100%=15%×120г.÷100%=18г.
3. M(HNO₃)=63г./моль,
n₁(HNO₃)=m(HNO₃)÷M(HNO₃)=18г.÷63г./моль=0,3моль
4. 3Cu+8HNO₃=3Cu(NO₃)₂+2NO+4H₂O
по уравнению реакции:
n(Сu)=3моль n(HNO₃)=8моль
по условию задачи:
n₁(Сu)=0,8моль n₁(HNO₃)=0,3моль
В действительности потребуется n₁(HNO₃)=2,1моль азотной кислоты, значит азотная кислота дана в недостатке. Дальше задачу решаем, используя данные по азотной кислоте:
по уравнению реакции:
n(HNO₃)=8моль n(NO)=2моль
по условию задачи:
n₁(HNO₃)=0,3моль n₁(NO)=0,08моль
5. Определим объем оксида азота(ll) количеством вещества 0,08моль:
V(NO₂)= n₁(NO)xVm=0,08моль
х22,4л./моль=1,79л.
6. ответ: при взаимодействии меди массой 59 г с 120 г 15% раствором азотной кислоты образуется 1,79л.оксида азота(ll).
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем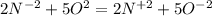 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам