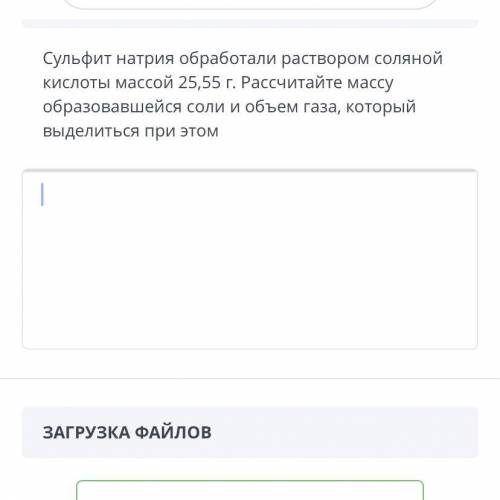
Дано:
V(CO₂) = 11,2 л
m(р-ра) = 57,6 гр
Найти:
ω(KHCO₃) - ?
ω(K₂CO₃) - ?
1) Запишем уравнение реакции, с этой реакции мы будем составлять пропорцию, при пропорции мы найдем массу смеси кислой и средней соли:
11,2 л x - гр y - гр
2CO₂ + 3KOH → K₂CO₃ + KHCO₃ + H₂O
2 моля 1 моль 1 моль
44,8 л/моль 138 гр/моль 100 гр/моль
2) Найдем молекулярный объем углекислого газа, и молекулярные массы смеси кислой и средней соли:
V(CO₂) = 2Vm = 2×22,4 л/моль = 44,8 л/моль
M(K₂CO₃) = 39×2+12+16×3 = 78+12+48 = 138 гр/моль
M(KHCO₃) = 39+1+12+16×3 = 39+1+12+48 = 40+60 = 100 гр/моль
3) Мы составили пропорцию под пунктом (1), при этой пропорции мы найдем массу средней и кислой соли:
x = 138 гр/моль × 11,2 л/44,8 л/моль = 138 гр/моль × 0,25 моль = 34,5 гр ⇒ m(K₂CO₃) = m₁(в-ва) = 34,5 гр
y = 100 гр/моль × 11,2 л/44,8 л/моль = 100 гр/моль × 0,25 моль = 25 гр ⇒ m(KHCO₃) = m₂(в-ва) = 25 гр
4) Мы нашли массы средней и кислой соли теперь мы находим массовые доли по такой формуле:
ω(в-ва) = m(в-ва)/m(р-ра) × 100%
1') K₂CO₃:
ω(K₂CO₃) = m(K₂CO₃)/m(р-ра) × 100% = 34,5 гр/57,6 гр × 100% ≈ 0,599 × 100% ≈ 59,9%
2') KHCO₃:
ω(KHCO₃) = m(KHCO₃)/m(р-ра) × 100% = 25 гр/57,6 гр × 100% ≈ 0,434 × 100% ≈ 43,4%
ответ: ω(K₂CO₃) = 59,9% ; ω(KHCO₃) = 43,4%
ответ: 5.0 г
Объяснение:
Лучше, конечно, посмотрите прикрепленный файл.
Или так:
Дано:
mнач(Sn)=16,9 г
mр(FeBr3)=435.5г
ω1(FeBr3)=20%
ω2(FeBr3)= ω (SnBr2)
m (пластинки) - ?
Металлическое олово восстанавливает ионы Fe3+ в ионы Fe2+:
Sn+ FeBr3= SnBr2+ FeBr2.
Пусть прореагировало х моль олова, образовалось х моль SnBr2, m(SnBr2)=279х (г).
По уравнению реакции n(FeBr3)= 2n(Sn)=2х (моль), масса прореагировавшего FeBr3:
mпрореаг(FeBr3)= 2х▪296=592 х (г).
В исходном растворе содержалось FeBr3:
mв р-ре(FeBr3)= mр(FeBr3)▪ ω1(FeBr3)=435,5▪0,2=81,7 (г).
После реакции в растворе осталось FeBr3:
mост(FeBr3)= m в р-ре (FeBr3)- mпрореаг(FeBr3)=87,1-592х (г).
По условию задачи массовая доля бромида железа (III) стала равна массовой доле бромида олова (II):
ω2(FeBr3)= ω (SnBr2)
(m_ост (〖FeBr〗_3 ))/m_(р-ра) =(m_ (〖SnBr〗_2 ))/m_(р-ра)
m_ост (〖FeBr〗_3 )=m_ (〖SnBr〗_2 )
Составим и решим уравнение:
87,1-592х=279х
87,1=871х
х=0,1,
т.е. прореагировало 0,1 моль олова.
Масса прореагировавшего олова:
mпрореаг(SnBr2)= nпрореаг(SnBr2)▪ M(SnBr2)=0.1▪119=11,9(г).
Тогда m (ложки)= mнач(Sn)- mпрореаг(SnBr2)=16,9-11,9=5,0 (г).
ответ: 5,0 г.
Объяснение:
25,55 г Х г Х л
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
n=2 моль n=2 моль n=1 моль
М = 36,5 г/моль М=58,5 г/моль Vm=22,4 л/моль
m=73 г m=117 г V = 22,4 л
25,55 г HCl - Х г NaCl
73 г HCl - 117 г NaCl
m(NaCl) = 25,55 * 117 / 73 =40,95 г
25,55 г HCl - Х л SO2
73 г HCl - 22,4 л SO2
V(SO2) = 25,55 * 22,4 / 73 =7,84 л