На основании обширного экспериментального материала в 1867 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали основной химической кинетики, который устанавливал зависимость скорости химической реакции от концентрации реагирующих веществ.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Скорость простой (злементарной), протекающей в одну стадию реакции и записанной в общей форме: (см. приложение-фото)
где v — скорость реакции, C A — молярная концентрация вещества А, C B — молярная концентрация вещества В, m n их коэффициенты, а k — константа, которая равна скорости реакции при концентрации реагирующих веществ 1 моль/л (справочная величина).
проще говоря:
От тепературы: При повышении температуры скорость химической реакции увеличивается. Т.К. увеличивается число активных частиц засчёт получения ими дополнительной энергии.
От концентрации: Чем выше концентрация реагентов тем больше скорость химической реакции(увеличивается число столкновений).
Пример:Взаимодействие цинка и соляной кислоты(концентрация уменьшится,При нагревании реакция идёт более быстрей).
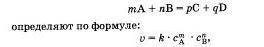
Запишем уравнения реакции:
C6H12O6 = 2C2H5OH + 2CО2 ↑
Из уравнения реакции видно, что:
ν(C2H5OH)=ν(CO2)
m(C2H5OH)/M(C2H5OH)=V(CO2)/Vm(CO2)
Определим молярную массу этилового спирта:
M(C2H5OH)=12*2+1*5+16+1 = 46 г/моль
Определим теоретическую массу спирта:
m(C2H5OH)=V(CO2)*M(C2H5OH)/Vm(CO2)
Подставим числовые значения, переведя 112 м³ в 112000 л:
m(C2H5OH)=V(CO2)*M(C2H5OH)/Vm(CO2)=112000*46/22,4=230000 г.
Теперь найдем практический выход спирта:
m(C2H5OH)*0,85=195500 г.
ответ: практический выход спирта 195500 г или 195,5 кг.
Объяснение:
вроде это