У любого газа есть такое понятие как "количество вещества", которое измеряется в молях. Оно вычисляется по формуле:
n=V/Vm,
где n - количество вещества [моль],
V - объем вещества [литр]
Vm - молярный объем, Vm=22,4 [моль/л], т.е. в объеме 22,4 л содержится 1 моль любого газа (при нормальных условиях, т.е. нормальном давлении и нормальной температуре).
У любого не газообразного вещества тоже есть понятие "количества вещества", и тоже измеряется в молях, но тут другая формула:
n=m/M,
где m - масса вещества [граммы]
М - молярная масса [грамм/моль], молярную массу любого вещества высчитывают путем сложения атомных масс всех входящих в вещество элементов с учетом индексов, например M(H₂SO₄)= 2×1 + 32 + 4×16= 98 г/моль. Значения атомных масс для каждого элемента записаны в таблице Менделеева.
Итак, вне зависимости от того, что нам дано в условии задачи, мы всегда можем найти молярный объем для любого газа (Vm) и молярную массу для твердого вещества (М).
Все задачи на нахождение объема газа, необходимого для реакции с определенным количеством другого вещества решаются через пропорции. Например:
какой объем водорода выделится при взаимодействии алюминия с раствором серной кислоты, содержащим 9,8 г H₂SO₄.
Последовательность решения задачи:
1) пишем уравнение реакции
2) пишем, что нам известно, или что мы можем подсчитать самостоятельно.
3) составляем пропорцию
1) уравнение реакции: 2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂
2)Нам дано:
m(H₂SO₄)= 3,65 г
Сами мы можем найти:
М(H₂SO₄)= 2×1 + 32 + 4×16= 98 г/моль
Vm (H₂)= 22,4 л/моль
3) составляем пропорцию по уравнению реакции, для этого объединяем известные нам данные с неизвестным (которое принимаем за х)
Т.к. по уравнению реакции у нас 3 моль H₂SO₄ дают 3 моль H₂, то в пропорции мы это обязательно должны учесть:
3 моль×98 г/моль H₂SO₄ дают 3 моль×22,4 л/моль H₂, после перемножения и сокращения моль получаем:
294 г H₂SO₄ дают 67,2 л H₂
9,8 г H₂SO₄ дают х л H₂
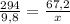
Откуда:
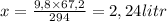
21,2 грамма
Объяснение:
Вычислим молярные массы углекислого газа и гидроксида натрия
Mr(СО2)=12+2*16=44 г/моль
Mr(NaOН)=23+16+1=40 г/моль
Вычислим количество вещества гидроксида натрия и углекислого газа:
n(NaOН)=m(NaOН)/Mr(NaOН)=2/40=0,05 моль
n(СО2)=m(СО2)/Mr(СО2)=0,88/44=0,02 моль
Напишем уравнение реакции:
СО2+2NaOH=Na2CО3 +H2O
По уравнению реакции щелочи должно быть взято в 2 раза больше, чем углекислого газа. В нашем случае взято в 2,5 раза больше, то есть щелочь в избытке. Следовательно, рассчитываем массу карбоната натрия по углекислому газу.
По уравнению реакции, так как перед углекислым газом и Na2CО3 стоят коэффициенты 1 следует, что соли также получится 0,2 моля.
вычислим ее массу:
Mr(Na2СО3)=2*23+12+3*16=106 г/моль
m(Na2СО3)=n(Na2СО3)*Mr(Na2СО3)=0,2*106=21,2 грамма