77.8 г
Объяснение:
Формула железного купороса - FeSO₄·7H₂O. Его молярная масса состоит из молярных масс сульфата железа (152 г/моль) и семи молекул воды (18 * 7 = 126 г/моль) и составляет 152 + 126 = 278 г/моль. Так как расчет на 1 моль вещества, то можем сказать, что в 278 г купороса содержится 152 г сульфата железа. Тогда в 5 г купороса содержится (5 * 152) / 278 ≈ 2.734 г сульфата железа
Пусть взяли х г 5%-го раствора. Тогда масса сульфата железа в нем будет 0.05х г. Теперь это все подставим в формулу
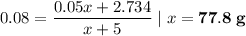
Состав 1:
Дихромат калия — 60 г
Концентрированная серная кислота — 80 мл
Вода — 270 мл
Состав 2:
Дихромат калия — 15 г
Концентрированная серная кислота — 500 мл
Состав 3:
Дихромат калия — 50 г
Концентрированная серная кислота — 1 л
Состав 4:
Дихромат калия - 10 г
Концентрированная серная кислота - 100 мл
Вода - 10-20 мл (если при приготовлении хромпика было добавлено много воды, то из раствора выпадает оранжевый осадок, чтобы его растворить необходимо добавить дополнительное количество серной кислоты)
Объяснение:
Н зачто бро)))