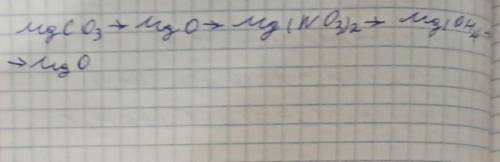
а) FeCl₃
FeCl₃ хлорид железа (III) - соль образована слабым основанием и сильной кислотой, гидролиз будет проходить по катиону .
FeCI₃ + 2H-OH ⇄ (Fe(OH)CI₂ + HCI
Fe³⁺+ 3CI⁻ + 2H-OH ⇄ Fe(OH)⁺ +2CI⁻ + H⁺ + CI⁻
Fe³⁺+ 2H-OH ⇄ Fe(OH)²⁺ + H⁺
Среда раствора кислая ( pH < 7 )
б) Na₂S
Na₂S сульфид натрия - соль, образована сильным основанием и слабой кислотой, гидролиз будет проходить по аниону:
Na₂S+ 2H-OH ⇄ NaHS + NaOH
2Na⁺ + S²⁻ + 2H-OH ⇄ Na⁺ + HS⁻ + Na⁺ + OH⁻
S²⁻ + 2H-OH ⇄ HS⁻ + OH⁻
Среда раствора щелочная (pH > 7 )
в) K₂SO₄
K₂SO₄ сульфат калия - соль образована сильным основанием и сильной кислотоы не подвергается гидролизу, и раствор нейтрален.
г) CuCO₃ карбонат меди нерастворимая соль в воде, гидролиз не произойдет.
Пример Гидролиза соли слабой кислоты и слабого основания. В таких соединениях гидролиз протекает до конца, в данном случае гидролиз необратим, так как оба вещества выходят из сферы реакции.
(NH₄)₂S — соль образована слабым основанием NH₄OH и слабой кислотой H₂S
(NH₄)₂S + H₂O =2NH₃↑ + H₂O + H₂S↑
осталась только вода H₂O — нейтральная среда, pH=7
Это гидролиз и по катиону, и по аниону
1) Молярная концентрация раствора показывает сколько молей данного вещества содержится в 1 л раствора. А нормальная концентрация показывает, сколько моль-эквивалентов данного вещества находится в 1 л раствора.
2) Na₂CO₃ молярная масса вдвое больше молярной массы эквивалента. Значит 0,25Н раствор, это 0,125М раствор.
3) Чтобы узнать количество молей растворенного вещества в растворе, нужно молярность умножить на количество литров раствора.
2) Обозначим объём 1,5М раствора через Х литров.
При разбавлении раствора количество молей растворенного вещества не изменяется, на основании этого можем написать уравнение:
1,5 * Х = 0,125 * 2
1,5Х = 0,25
Х = 0,167 л = 167 мл
MgCO3 → MgO + CO2
MgO + 2HNO3 (разб. р-р)→ Mg(NO3)2 + H2O
Mg(NO3)2 + 2NaOH (разб. р-р)→ Mg(OH)2 + 2NaNO3
Mg(OH)2 → MgO + H2O
Объяснение: