5.
16,2 г х г
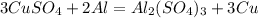
54 г 192 г
При взаимодействии 54 г алюминия образуется 192 г меди,а
при -- // -- 16,2 г __________________х г, откуда
х=16,2*192/54=57,6 г
1.
21,6 г 51,2 г,х г у г
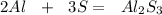
54 г 96 г 150 г
1. Рассчитаем,какое из исходных веществ прореагировало полностью(без остатка),приняв массу серы за Х:
для полного взаимодействия 54 г алюминия необходимо 96 г серы,а
для -- // -- 21,6 г___________________х г, откуда
х=21,6*96/54=38,4 г
2. Так как необходимо всего 38,4 г серыа дано(по условиям задачи) 51,2 г,то серы немного останется не прореагировавшей(излишек),значит массу соли находим по массе алюминия:
при взаимодействии 54 г алюминия образуется 150 г соли, а
при -- // -- 21,6 г__________________у г, откуда
у=21,6*150/54=60 г
33,3 г 66 г х г
HClO4 + NaOH = NaClO4 + H2O
100,5 г 40 г 122,5 г
Узнаем массу всего раствора - она останется неизменной по закону сохранения масс:
100*1,11 + 300*1,1 = 111 + 330 = 441 г.
Причем хлорной кислоты в нем: 111*0,3 = 33,3 г, а гидрооксида натрия - 330*0,2 = 66 г.
Из анализа молярных масс видим, что NaOH взят в избытке. Поэтому выход перхлората считаем по хлорной кислоте:
33,3 - х
100,5 - 122,5
Отсюда: х = 33,3*122,5 / 100,5 = 40,6 г
Пусть у г - требуемая масса воды. Тогда имеем уравнение:
0,08(441+у) = 40,6
у = (40,6/0,08) - 441 = 66,5 г
Что соответствует 66,5 мл воды.
ответ: 66,5 мл.
1)3Cu + 8HNO3(р)= 3Cu(NO3)2 +2NO +4H2O
2) 2KMnO4 + 16HCl = 2KCl + 2 MnCl2 +5 Cl2 + 8H2O
3) 4NH3 + 3PbO2 = 2N2+ 3Pb + 6H2O