22,4
Объяснение:
Дано:
m(CaO) = 112 г
Найти:
V(O₂) = ?
Реакция: 2Ca + O₂ → 2CaO
Сначала находим количество вещества оксида кальция:
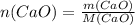 , где M(CaO) - молярная масса CaO, которая считается как сумма атомных масс Ca и O (даны в таблице Менделеева)
, где M(CaO) - молярная масса CaO, которая считается как сумма атомных масс Ca и O (даны в таблице Менделеева)
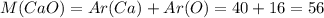 г/моль
г/моль
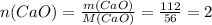 моль
моль
По реакции видно, что оксида кальция в 2 раза больше, чем затраченного кислорода (по коэффициентам смотрим: у CaO 2, у O₂ 1). Поэтому и количество вещества у кислорода будет в 2 раза меньше, чем у оксида кальция:
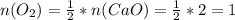 моль
моль
Объем считаем по формуле:
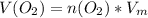 , где
, где 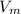 - молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
- молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
Подставляем и решаем:
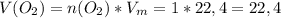 л
л
ответ: 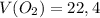 л
л
M(AgNO3) = 170 г/моль . n(AgNO3) = m/M = 10.2/170 = 0.06 моль
M(Na3PO4) = 164 г/моль, n(Na3PO4) = 6.56/164 = 0.04 моль
3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4 (осадок)
в недостатке AgNO3 . n(NaNO3) = 0.06 моль, m(NaNO3) = M*n = 85*0.06 = 5.1 г - масса нитрата натрия в растворе, m(Na3PO4) = 164*(0.04 - 0.06/3) = 3.28 г - избыток ортофосфата натрия в растворе . n(Ag3PO4) = 0.06/3 = 0.02 моль, m(Ag3PO4) = M*n = 419*0.02 = 8.38 г - масса осадка ,
m(раствора) = 100 + 50 - 8,38 = 141,62 г
w(NaNO3) = 5.1*100/141.62 = 3.6%, w(Na3PO4) = 3.28*100/141.62 = 2.32%
Объяснение:
кальций элемент металл находящийся главной подгруппе 2 группы,валентность равна 2,число электронов равно числу протонов и равно 20(порядковый номер),Оксид кальция выглядит так CaO.Электронная конфигурация внешнего слоя 4s^2
Алюминий - Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.Al +13 )2)8)3 , p – элемент,Основное состояние1s2 2s2 2p6 3s2 3p1
Алюминий проявляет в соединениях степень окисления +3:Al0 – 3 e- → Al+3