
3,81 г х г
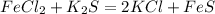
127 г 88 г
1. Сначала необходимо найти чистую массу хлорида железа,для чего достаточно умножить массу раствора на массовую долю хлорида(6% - это 0,06,но без процентов):
m(FeCl2)=m(раствора)*w(FeCl2)=63,5*0,06=3,81 г
2. Подставив эту массу в уравнение,получим:
при взаимодействии 127 г хлорида железа выпадет 88 г осадка(сульфида железа),а при--//-- 3,81 г______________________х г, откуда
х=3,81*88/127=2,64 г (это ответ)
2,5 г 7,5 г,х г у г

40 г 73 г 22,4 г
1. Найдем чистую массу кислоты в растворе:
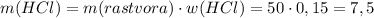 г
г
2. Подставив в уравнение эту массу,мы сначала должны удостовериться,какое из веществ прореагирует полностью(без остатка),поэтому примем массу одного из исходных веществ за Х,например массу кислоты:
для полного взаимодействия 40 г кальция потребуется 73 г кислоты,а
для -- // -- 2,5 г__________________х г , откуда
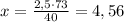 г
г
3. Согласно этого кислота дана в избытке,т.е. полностью прореагирует кальций,значит расчеты объма водорода нужно вести по массе именно кальция:
при взаимодействии 40 г кальция выделяется 22,4 л водорода,а
при -- // -- 2,5 г__________________у л, откуда
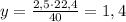 л (это ответ)
л (это ответ)
w(C)=92.31%
w(O)=7.69%
D(O2)=0.8125
Найти:
CxHy-?
Решение:
Общая формула алкинов CnH2n-2
x:y=92.31/12 : 7.69/1 = 7.69 : 7.69
Значит х:у=1:1
У алкино только одно такое вещество
это C2H2-этин,но мы это проверим:
D(O2)=CxHy/32=0.8125
CxHy=26
Получается что молярная масса этого вещества должна быть 26г/моль
C2H2=12*2+2*1=26г/моль
Значит это то вещество.
ответ:С2Н2-этин.