С кислородом взаимодействуют практически все вещества. Процесс окисления идет всегда и везде, ведь это одна из частей разложения вещества. И если нагреть, все вещества будут взаимодействовать с кислородом.
С кислородом не взаимодействуют, наверно, только ленивые. Золото, платина, палладий. Туда же еще иридий, осмий, рутений.
А с неметаллами не взаимодействует кремний. А также, не могут взаимодействовать, конечно, гелий, неон, ксенон, аргон, криптон. Ну может быть там из-за огромной орбитали и жестких условий ксенон да радон окислятся, но остальные еле как с фтором под давлением взаимодействуют. А он сильнее кислорода.
Здесь все говорится про атмосферные, стандартные условия. При нагреве, повторюсь, все окисляется. Кроме благородных газов с маленькой орбиталью - гелий и неон.
Объяснение:
Найдем количество молей водорода и кислорода в смеси, то есть, сколько моль веществ содержится в 1 моле смеси.
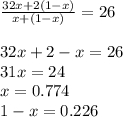
Выходит, что число молей кислорода равно 0.774 на 1 моль в смеси, а число молей водорода равно 0.226 моль на 1 моль смеси. Остается лишь умножить значения на 5, ведь спрашивается про 5 моль смеси.
n(O2)=0.774 * 5 = 3.87 моль
n(H2)=0.226 * 5 = 1.13 моль
При реакции водорода и кислорода образуется вода:
2H2 + O2 => 2H2O
Соотношение водорода и кислорода в реакции 2:1. 2 моля водорода на 1 моль кислорода. Выходит, что кислород в избытке. Считаем по водороду:
n¹(O2) = 0.5n¹(H2) = 0.565 моль
Все 1.13 моль водорода расходуются, вместе. сними уходит 0.565 моль кислорода. Значит, осталось еще:
3.87 моль - 0.565 моль = 3.305 моль кислорода.
Объяснение:
Дано:
m(соли) = 27 г
m(H₂O) =513г
Найти:
ω(соли )-?
Решение.
Находим массу раствора:
m(p-ра.) = m(р.в-ва)+m(H₂O) = 27 г+513г=540г
Находим массовую долю соли
Mассовая доля растворенного вещества = Mассе растворенного вещества / Масса раствора *100%
ω = m р.в-ва/ m р-ра*100%
ω(соли ) = m(соли )/m(p-ра.) = 27 г/540 г =0,05 или 5%
ответ: 5%