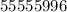
Объяснение:
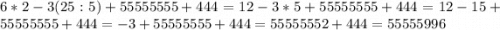
Объяснение:
Массовая доля элемента в его оксиде равна 77,91%, определить элемент и этот оксид
Примем массу оксида равной 100 г. Тогда масса элемента составит 77,91 г, а масса кислорода 22,09 г
По закону эквивалентов можно записать:
m Э Mэкв Э 77,91 х 8 × 77,91
= = х = = 28,2
m O Мэкв О 22,09 8 22,09
Молярная масса эквивалента элемента 28,2 г/моль.
Тогда если в оксиде элемент одновалентный, его молярная масса равна 28,2 г/моль, если двухвалентный 56,4, если трехвалентный 84,6 если четырехвалентный 112,8
Наиболее близкое значение значение для железа. Молярная масса железа 55,847 г/моль, Молярная масса оксида железа 71,846 ω (Fe) в оксиде железа (II) = 77,7%
1 - 3
2 - 2
3 - 2
4 - 1
5 - 1
6 - 2
7 - 3
8 - 3
9 - 3
10 - 3
11 - БГЕ
---------------
ЧАСТЬ Б
1) N2 + O2 = 2NO
v(n2) - 15.6л (условие)
найдем через пропорцию:
1 моль n2 соответствует 2 моль no, тогда
v(no) 15,6/1 = x/2 =15.6*2 = 31.2 л
ответ - 31.2 л
2) Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
m(Al2(SO4)3)= 50г
n(Al2(SO4)3) =m/M = 50/342=0.146моль
через пропорцию найдем кол-во моль у гидроксида алюминия
1/0.146 = 2/x
x=n(Al(OH)3) = 2*0.146 = 0.292 моль
m (Al(OH)3) = M*n =78*0.292 = 22.776 = 22.8г
ответ - 22.8г
--------------------
ЧАСТЬ С
1) На фото 1 - молекулярное 2- ионное 3- краткое ионное
2) фото
3) фото
S - Восстановитель- проходит окисление/ Mn - окислитель - проходит восстановление

Объяснение: